|
|
|
|
Totalsynthese des marinen Makrolids Neopeltolid |
|
Die Vollsynthese des Moleküls könnte zur Entwicklung neuer Krebsmittel führen. |
|
Durch diesen Artikel wurde das Interesse von Karl A. Scheidt geweckt, der als Synthesechemiker von Naturstoffen mit medizinischem Potenzial fasziniert ist und sofort wusste, was zu tun ist: Das Molekül synthetisieren. Sechs Monate später war diese Aufgabe erledigt; nur: Die Spektren der synthetisierten Substanz stimmten nicht mit denen des isolierten Naturstoffes überein. |
|
Als Ursache für dieses Problem boten sich den Wissenschaftlern zwei Möglichkeiten: Entweder hatten Scheidt und seine Mitarbeiter Daniel W. Custar und Thomas P. Zabawa bei der Synthese einen Fehler gemacht - oder die Neopeltolid-Struktur aus dem Originalartikel war falsch. Scheidt und sein Team überprüften ihre Experimente und Überlegungen und fanden, dass sie genau richtig lagen; die Neopeltolid-Struktur aus Amy Wright`'s Artikel war falsch. Nochmals - unter Verwendung einfacher Ausgangssubstanzen und Anwendung komplexer Synthesewege - synthetisierten die Chemiker ein neues Molekül, das sich ein wenig (an den C-Atomen C11 und C13) vom ersten unterscheidet und dessen Spektraldaten exakt mit denen der isolierten Verbindung übereinstimmen. Ihre Ergebnisse veröffentlichten Sie in Journal of the American Chemical Society 2). |
||
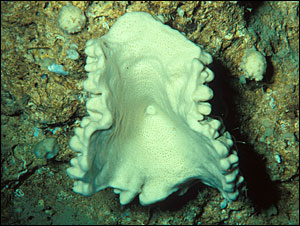
Die gewonnenen Erkenntnisse über die Neopeltolid-Struktur wird Wissenschaftlern dazu verhelfen, die Wirkungsweise dieser Substanz zu verstehen, was wiederum zur Entwicklung sehr wirksamer Krebsmedikamente führen kann. Über das Potenzial der neu entdeckten Substanz bemerkt Karl A. Scheidt, dass die beobachtete biologische Aktivität phantastisch sei, im Vergleich zum Taxol®, einer ebenfalls natürlich vorkommenden Verbindung der pazifischen Eibe, bei einigen Krebsarten etwa zwei bis drei Größenordnungen effektiver. Einige Tierarten (und auch Pflanzen) bilden verschiedene chemische Abwehrmechanismen aus, besonders, wenn sie wie im Fall des vorliegenden Tiefsee-Schwamms, sich nicht bewegen und vor Fressfeinden fliehen können. Für Forscher sind diesen natürlichen chemischen Fabriken besonders interessant, weil sie eine Vielzahl von Anregungen liefern, Ideen für pharmazeutische Wirkstoffe und selbst Wege zur Entwicklung von Krebsmedikamenten aufzeigen. "Die Natur ist die Apotheke überhaupt", bemerkt Scheidt hierzu. Beeindruckt von dieser Arbeit zeigte sich Amy Wright, die das Neopeltolid aus einem Schwamm isolierte, den sie 1993 von Jamaika mitbrachte. In ihrem Artikel beschreibt sie Neopeltolid als wirksamen Hemmstoff bei Zellen der Lungenadenokarzinom-Linie A549, bei der Leukämie-P388-Zelllinie und anderen sowie als wachstumshemmend auf Zellen des pathogenen Pilzes Candida albicans. Laut Scheidt stoppt Neopeltolid die Zellteilung an ungewöhnlichen Stellen, und auch die Aktivität unterscheidet sich von anderen allgemein bekannten und verwendeten Chemotherapeutika: "Wir wissen, dass etwas anderes bei diesem neuen Molekül passiert, und wir wollen es herausfinden, wenn diese Wirkung einer neuer Weg zur Krebsbekämpfung ist."
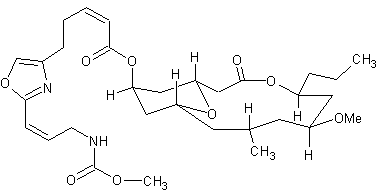
Neopeltolid-Synthese Der wesentliche Schritt der Bindungsbildung in Scheidt`s Synthese ist eine Lewissäure-katalysierte intramolekulare Cyclisierung, die zur gleichzeitigen Bildung des Tetrahydropyranringes und des Makrocyclus führt. Diese Art der Cyclisierung wurde hier erstmals angewandt und führt effektiv zum gezeigten Kohlenstoff-Grundgerüst. Gleichzeitig und unabhängig voneinander arbeitete ein weiteres Team um James S. Panek von der Universität Boston an der Synthese und der Strukturaufklärung des Neopeltolids 3). Auch diese Wissenschaftler korrigierten die von Wright publizierte Struktur. Die Synthese dieser Forschergruppe erfolgte unter anderem über eine modifizierte Evans-Tischtschenko-Reduktion zur Einführung des Stereozentrums C11, eine [4+2]-Anellierung zum Pyransystem und eine Still-Gennari-Olefinierung zum Aufbau der Oxazol-Seitenkette. Neopeltolid wird chemisch den Makroliden [auch: Makrolaktone] zugeordnet. Makrolide sind nach Woodward [Angewandte Chemie 69 (157) Seite 50 bis 58] makrocyclische Verbindungen, die eine Lactongruppierung enthalten. Bekannte Vertreten dieser Gruppe sind die Makrolidantibiotika (z. B. Erythromycin; Clarithromycin; Azithromycin; Roxithromycin; ...); Antimykotika wie Nystatin und Natamycin; Topische Immunsuppressiva; das Mykotoxin Zearalenon u. a. |
|
|
|
|
Suche nach themenverwandten Internetseiten: |
|
|