Marburger Chemiker haben ein Aminosäure-Imitat hergestellt, das sich in Proteine einbauen lässt, die dadurch ihre Beweglichkeit einbüßen.
Die neue Verbindung soll es leichter machen, künstliche Proteine zu synthetisieren, deren räumliche Gestalt sich präzise vorhersagen lässt.
Das US-amerikanische Wissenschaftsmagazin "Proceedings of the National Academy of Sciences" (PNAS) berichtete in der Oktober-Ausgabe 2010 über die Ergebnisse des Forscherteams um Professor Dr. Lars-Oliver Essen und Professor Dr. Armin Geyer von der Philipps-Universität.
Proteine bestehen aus Ketten von Aminosäuren. In der Natur finden 20 Aminosäure-Typen Verwendung; neue, künstlich hergestellte Formen könnten jedoch zu Proteinen mit erwünschten Eigenschaften führen. "Weltweit suchen Chemiker und Biochemiker nach neuen Aminosäuren, die sich in Proteine integrieren lassen", erklärt Senior-Autor Armin Geyer. Er und seine Kollegen sind auf diesem Weg nun einen großen Schritt weitergekommen. Die von ihnen beschriebene Verbindung geht nämlich Wechselwirkungen mit benachbarten Strukturen innerhalb des Proteins ein, in das sie eingebaut wird, und bestimmt dadurch dessen dreidimensionale Form.
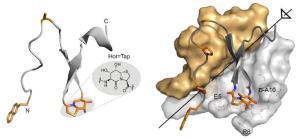
Die Wissenschaftler nahmen sich ein synthetisches Minimal-Protein vor und ersetzten zwei seiner herkömmlichen Aminosäuren durch ein Imitat mit dem Namen "Hot=Tap", das die Gestalt einer Haarnadelkurve hat. Hot=Tap hält die benachbarten Aminosäureketten wie ein Scharnier in einer vorhersagbaren Form fest. Als stabile Oberflächenstrukturen können sie ganz bestimmte Antikörper binden, vergleichbar einem Schlüssel, der nur in das entsprechende Schloss passt.
Während ein Protein normalerweise seine Gestalt in Grenzen ändern kann wie ein Gummiball, sorgt Hot-Tap für eine feste Form - Voraussetzung für spezifische Interaktionen, wie sie von Präparaten erwartet wird, die keine unerwünschten Nebenwirkungen hervorrufen. "Für planbare Architekturen von Aminosäureketten besteht großer Bedarf in der medizinischen Forschung", erläutert Ko-Autor Lars-Oliver Essen. Die Wissenschaftler haben sich als ein erstes Anwendungsbeispiel die Alzheimer-Krankheit vorgenommen.
Zusatzinformationen:
Björn Eckhardt, Wolfgang Grosse, Lars-Oliver Essen, Armin Geyer:
Structural characterization of a β-turn mimic within a protein-protein interface.
In: Proceedings of the National Academy of Sciences; PNAS, online veröffentlicht am 11. Oktober 2010, DOI 10.1073/pnas.1004187107
Quelle: Philipps-Universität Marburg, PUMa
Aktualisiert am 18.10.2010.
Permalink: https://www.internetchemie.info/news/2010/oct10/künstliche_proteine_mit_hot-tap.php
© 1996 - 2024 Internetchemie ChemLin