Formiat, das Salz der Ameisensäure, ist ein wichtiges Stoffwechselprodukt in Bakterien und - im Unterschied zum menschlichen Stoffwechsel - eine Vorstufe des Gases Kohlenstoffdioxid, das bei der Verbrennung von Zuckern freigesetzt wird.
Enterobakterien, zu denen das Darmbakterium Escherichia coli, aber auch Krankheitserreger wie Vibrio cholerae und Salmonella typhimurium gehören, besitzen mit dem Formiatkanal FocA ein spezialisiertes Transportprotein, welches das negativ geladene Ion der Ameisensäure über die Zellmembran der Bakterien transportiert.
Die Besonderheit des Kanalproteins liegt in einem Umschaltmechanismus zum Schließen, der durch ein Absinken des extrazellulären pH-Werts ausgelöst wird: Bei hohem pH-Wert funktioniert das Protein als Kanal, welcher Formiat-Anionen aus der Zelle hinausströmen lässt, während ein Absinken des pH-Werts das Protein in eine Pumpe zur aktiven Aufnahme von Formiat aus der Umgebung macht.
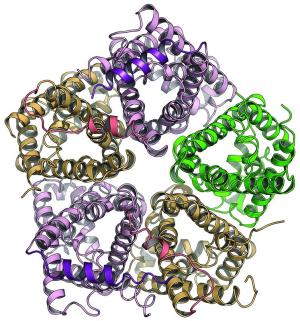
Dr. Wei Lü und Juan Du aus der Arbeitsgruppe von Prof. Dr. Oliver Einsle, Institut für organische Chemie und Biochemie der Universität Freiburg, gelang die Isolation und Kristallisation von FocA aus dem Bakterium Salmonella typhimurium bei niedrigem pH-Wert. Das bislang lediglich postulierte Schließen dieser Kanäle bei fallendem pH-Wert konnte in Zusammenarbeit mit Tobias Wacker aus der Emmy-Noether-Nachwuchsgruppe von Dr. Susana Andrade am gleichen Institut direkt gezeigt werden.
Ein derartige Doppelfunktion wurde bislang bei keinem Transportprotein beobachtet. Die hoch aufgelöste Raumstruktur des pentameren Proteins zeigt, wie das Ende der Proteinkette sich quer über den Transportkanal legt, der die bakterielle Membran überspannt, ihn verschließt und dadurch verhindert, dass die Formiat-Ionen die Membran passieren. Diese Proteinbereiche sind bei hohen pH-Werten, wo FocA als passiver Kanal arbeitet, ungeordnet. FocA wurde im Labor in künstliche Membranen eingebaut. Elektroden messen direkt den elektrischen Strom, der durch den Transport der Formiat-Ionen bei verschiedenen pH-Werten erzeugt wird.
Zusatzinformationen:
Wei Lü, Juan Du, Tobias Wacker, Elke Gerbig-Smentek, Susana L. A. Andrade, and Oliver Einsle:
pH-Dependent Gating in a FocA Formate Channel.
In: Science; Vol. 332 no. 6027 pp. 352-354, 15. April 2011, DOI 10.1126/science.1199098
Quelle: Albert-Ludwigs-Universität, Freiburg im Breisgau
Aktualisiert am 15.04.2011.
Permalink: https://www.internetchemie.info/news/2011/apr11/formiatkanal-foca-ph.php
© 1996 - 2024 Internetchemie ChemLin