Ein Ball, der gegen eine Wand geworfen wird, prallt zurück.
Würde er sich quantenmechanisch bewegen, wie es Teilchen auf atomarer und molekularer Skala tun, hätte er eine gewisse Wahrscheinlichkeit, die Wand zu durchtunneln. Dies passiert umso häufiger, je dünner oder niedriger das Hindernis und je leichter das Teilchen ist.
Den Tunneleffekt bei Atomen zu simulieren, war bisher aufwendig und kompliziert.
Jun.-Prof. Johannes Kästner und sein Team vom Institut für Theoretische Chemie an der Universität Stuttgart haben eine Methode entwickelt, mit der erstmals Wahrscheinlichkeiten für Tunnelvorgänge in Molekülen der Größe von Enzymen, also mit mehreren zehntausend Atomen, berechnet werden können. Gerade für chemische oder biochemische Prozesse spielt der Tunneleffekt eine große Rolle, weil er die Reaktionen beschleunigt.
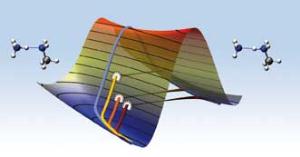
In der traditionellen Quantenchemie werden nur die Elektronen quan-tenmechanisch beschrieben, Atome jedoch klassisch. Mit dem neuen "Harmonic Quantum Transition State Theory" (HQTST)-Verfahren können die Stuttgarter sowohl Elektronen als auch Atome quantenmechanisch effizient beschreiben. Übersetzt heißt die Methode "Harmonische Quantenübertragungszustands-Theorie". Für die Simulation zogen die Wissenschaftler eine bereits 30 Jahre alte Theorie heran und entwickelten einen verbesserten Algorithmus. Dadurch werden Simulationen von Modellen realistischer Größe möglich, die zudem viel schneller Ergebnisse liefern. Die theoretischen Berechnungen haben im Gegensatz zum Experiment den Vorteil, dass die Chemiker den Tunneleffekt beliebig ein- und ausschalten können, um seine Wirkung zu erforschen."
Zurzeit untersucht Kästners Team in dem von der Landesstiftung Baden-Württemberg geförderten Projekt "Berechnung der Tunnelrate bei chemischen Reaktionen in großen Systemen" den Tunneleffekt von Atomen in biochemischen Prozessen. Zusammen mit den Projektpartnern im Exzellenzcluster SimTech der Universität Stuttgart und an anderen Universitäten im In- und Ausland wenden die Stuttgarter Wissenschaftler beispielsweise die HQTST-Methode an, um zu untersuchen wie das Enzym Glutamat-Mutase arbeitet. Das Enzym überträgt Wasserstoffatome auf Substrate. Die Chemiker nehmen an, dass dies erst durch den Tunneleffekt effizient geschieht. Erste Ergebnisse des Projekts deuten darauf hin, dass der Tunneleffekt tatsächlich die Enzymreaktion beschleunigt.
Mit der gleichen Methode haben die Stuttgarter Wissenschaftler bereits gezeigt, wie sich Wasserstoffatome im Weltraum zu Wasserstoffmolekülen verbinden können. Diese Reaktion läuft nur dank des Tunneleffekts effizient genug ab, um die experimentell gemessene Konzentration von Wasserstoffmolekülen zu erklären. Bei Temperaturen unter -200 Grad Celsius, die in interstellaren Wolken vorherr-schen, würde die Reaktion ohne den Tunneleffekt länger dauern als das Weltall existiert - ein Ding der Unmöglichkeit. Astronomische Messungen können zwar feststellen, welche Moleküle im Weltraum vorhanden sind, aber nicht wie diese gebildet werden. Die Simulation der Stuttgarter bringt Licht in diesen Prozess.
Zusatzinformationen:
Quelle: Universität Stuttgart
Aktualisiert am 22.06.2011.
Permalink: https://www.internetchemie.info/news/2011/jun11/biochemie-tunneleffekte.php
© 1996 - 2024 Internetchemie ChemLin