
Während der Urahn für die Bildung der Aminosäure Leucin zuständig ist, stellt der Nachfahre Senfölglykoside her, mit denen sich die Pflanze effektiv gegen Raupenfraß verteidigt. Nur kleine Änderungen in der chemischen Struktur haben dazu geführt, dass das Enzym eine völlig neue Aufgabe übernommen hat, die das Überleben der Pflanze sicherstellt.
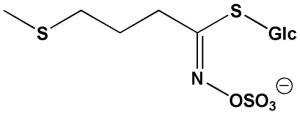
Pflanzen sind ständig Attacken durch Fraßfeinde ausgesetzt. Um sich davor zu schützen, haben sie ausgeklügelte chemische Verteidigungssysteme entwickelt. Kreuzblütler wie die Ackerschmalwand (Arabidopsis thaliana) schützen sich mit Senfölglykosiden vor Raupenfraß. Forscher kennen viele verschiedene Arten dieser Moleküle, die eine ähnliche Grundstruktur aufweisen und sich in ihren Seitenketten unterscheiden. Im Falle eines Raupenangriffs setzen die Senfölglykoside giftige Isothiocyanate frei. Chemiker sprechen von einer "Senfölbombe".
Verantwortlich für die Bildung der unterschiedlichen Senfölverbindungen sind Enzyme, die die Bildung verschiedener Seitengruppen katalysieren. Forscher am Max-Planck-Institut für chemische Ökologie in Jena haben nun aus der Ackerschmalwand ein Enzym dieser Gruppe isoliert und sind dabei auf eine Überraschung gestoßen. Wie Jan-Willem de Kraker und Jonathan Gershenzon herausfanden, ist das Enzym Methylthioalkylmalat-Synthase (MAM), das für die Produktion von Senfölglykosiden sorgt, in seiner Struktur einem zweiten Enzym sehr ähnlich, das jedoch eine ganz andere Funktion hat: Die Isopropyl-Malat-Synthase (IPMS) ist für die Bildung der Aminosäure Leucin zuständig. Zwei entscheidende strukturelle Unterschiede haben die Wissenschaftler gefunden: Bei MAM fehlen die letzten 120 Aminosäuren, und im aktiven Zentrum des Enzyms sind zwei Aminosäuren ausgetauscht. Das Gen, das für IPMS kodiert, geht bei Pflanzen wahrscheinlich bis auf die Cyanobakterien zurück. Die Forscher sehen deshalb darin die ursprüngliche Form, aus der sich das MAM-kodierende Gen entwickelt hat.
Das für die Leucin-Produktion wichtige Enzym IPMS kommt in Bakterien, Algen und höheren Pflanzen vor, nicht aber in tierischen Organismen. Für den Menschen ist Leucin daher eine essenzielle Aminosäure und muss mit der Nahrung aufgenommen werden. In der Ackerschmalwand liegt IPMS als Kette von 631 Aminosäuren vor, deren Reihenfolge durch ein entsprechendes Gen festgelegt wird. Die Anordnung der Aminosäuren bestimmt die räumliche Struktur und damit auch die biologische Funktion des Enzyms - in diesem Fall die Herstellung einer Leucin-Vorstufe. Damit dies nicht unkontrolliert geschieht, ist in den letzten 120 Aminosäuren der Kette ein Rückkopplungsmechanismus eingebaut. Ist in der Zelle genügend Leucin vorhanden, wird seine weitere Produktion gedrosselt. "Wir fanden, dass das Fehlen der 120 Aminosäuren nicht nur die Regulation der Enzymaktivität außer Kraft setzt, sondern die Architektur von MAM komplett verändert", sagt Gershenzon. So wirkt sich die Verkürzung der Aminosäurekette nämlich auch auf das aktive Zentrum des Enzyms aus. Im Vergleich zu IPMS kann MAM größere Moleküle binden und somit ganz neue Produkte erzeugen - Vorstufen von Senfölglykosiden anstatt von Leucin.
Ihre Entdeckung haben die Max-Planck-Wissenschaftler bei der Suche nach Genen gemacht, die für die Bildung von Senfölglykosiden wichtig sind. Im Zuge dieser Arbeiten haben sie das IPMS-Gen isoliert und sequenziert. Die Forscher nehmen an, dass sich das Gen im Verlauf der Evolution zunächst verdoppelt hat. Anschließend ist in einer der beiden Kopien der Bereich verloren gegangen, der die letzten 120 Aminosäuren des Enzyms kodiert. Wahrscheinlich ist dies bereits zu dem Zeitpunkt passiert, als die kreuzblütlerartigen Pflanzen (Brassicales) entstanden sind. Für die Pflanze erwies sich der Verlust als nützlich: Sie konnte Senfölglykoside bilden und war so vor Raupenfraß geschützt. Die Mutation zweier Basen hat anschließend das aktive Zentrum des Enzyms so verändert, dass es seine neue Funktion noch besser erfüllen konnte - die Abwehrstoff-Produktion wurde optimiert.
In Laborexperimenten haben de Kraker und Gershenzon ihre Annahmen bestätigt. Damit liefern sie ein neues Beispiel dafür, wie aus dem genetischen Fundus der Organismen ständig neue Variationen entstehen, die in der Natur ihre Tauglichkeit unter Beweis stellen müssen. Im evolutionsbedingten Wettlauf mit Schädlingen können so bereits kleine Änderungen zur Entstehung neuer chemischer Waffen führen. [JWK, HR]
Zusatzinformationen:
Jan-Willem de Kraker und Jonathan Gershenzon:
From Amino Acid to Glucosinolate Biosynthesis: Protein Sequence Changes in the Evolution of Methylthioalkylmalate Synthase in Arabidopsis.
In: The Plant Cell; Januar 2011, Vol. 23, Nr.1, Seite 38 - 53, DOI 10.1105/tpc.110.079269
Quelle: Max-Planck-Institut für chemische Ökologie, Jena
Aktualisiert am 23.03.2011.
Permalink: https://www.internetchemie.info/news/2011/mar11/methylthioalkylmalat-synthase.php
© 1996 - 2024 Internetchemie ChemLin