1999 erhielt Ahmed Zewail für seine Untersuchung von chemischen Reaktionen mit ultrakurzen Laserpulsen den Nobelpreis in Chemie. Zewail konnte die Bewegung von Atomen beobachten und dadurch Übergangszustände auf molekularer Ebene sichtbar machen.
Die Bewegung einzelner Elektronen beobachten zu können, schien damals noch Zukunftsmusik zu sein.
Dank neuer Lasertechnologie und intensiver Forschungstätigkeit auf dem Gebiet der Attosekundenspektroskopie (1 Attosekunde = 10-18 s) hat sich dieses Forschungsgebiet schnell entwickelt.
Prof. Hans Jakob Wörner vom Laboratorium für Physikalische Chemie der ETH Zürich ist es nun in Zusammenarbeit mit Gruppen aus Kanada und Frankreich gelungen, die Bewegung von Elektronen während einer chemischen Reaktion komplett zu verfolgen. Das Experiment wurde in der Oktober-Ausgabe 2011 des Fachmagazins Science beschrieben [siehe unten].
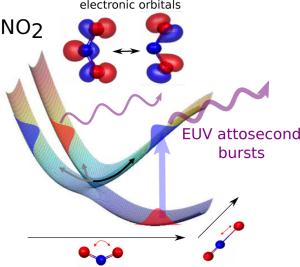
Das Forschungsteam bestrahlte Stickstoffdioxid (NO2) mit einem sehr kurzen ultravioletten Laserpuls. Das Molekül nimmt die Energie, welche in diesem Puls enthalten ist, auf und versetzt die Elektronen in Bewegung. Die Elektronen beginnen daraufhin, sich anders zu verteilen, wobei die Elektronenwolke für kurze Zeit in zwei unterschiedlichen Formen vorliegen kann. Dann gerät das Molekül in Schwingung und zerfällt schliesslich in Stickstoffmonoxid und ein Sauerstoffatom.
Konische Überschneidung
Stickstoffdioxid hat Modellcharakter im Bezug auf die Elektronenbewegung. Das Molekül besitzt eine ausgeglichene abgewinkelte Geometrie. Zudem ist klar, dass im NO2-Molekül zwei Zustände der Elektronen dieselbe Energie haben können - man spricht von einer konischen Überschneidung. Die konische Überschneidung ist zentral für die Photochemie und tritt in der Natur häufig bei chemischen Prozessen auf, die durch Licht ausgelöst werden. Die konische Überschneidung funktioniert wie eine Art Kippschalter. Trifft zum Beispiel Licht auf die Netzhaut, geraten auch dort die Elektronen in Bewegung, und die Netzhaut-Moleküle (Retinal) "klappen" um, was letztlich die Information des Lichts in elektrische Informationen fürs Hirn umwandelt. Das besondere an konischen Überschneidungen ist, dass die Elektronenbewegung sehr effizient in eine Bewegung der Atome übergeht.
Schnappschuss vom Elektron
Hans Jakob Wörner hat schon in einer früheren Publikation gezeigt, wie mit der Attosekundenspektroskopie die Bewegung von Elektronen beobachtet werden könnte. Der erste schwache Ultraviolett-Puls regt Elektronen zur Bewegung an. Ein zweiter starker Infrarot-Laserpuls entfernt ein Elektron aus dem Molekül, beschleunigt es und führt es wieder zurück ins Molekül. Bei diesem Prozess wird ein Attosekundenpuls emittiert, der eine Momentaufnahme der Elektronenverteilung im Molekül enthält. "Man könnte das mit Fotos vergleichen, auf denen zum Beispiel eine Gewehrkugel einen Apfel durchschlägt. Für den Verschluss ist die Kugel zu schnell, also lässt man den Verschluss ganz offen und belichtet mit Blitzen, die schneller sind als die Kugel. So entsteht der Schnappschuss", veranschaulicht Wörner das Prinzip der Attosekundenspektroskopie.
Vom Experiment zur Solarzelle
Wenn das Elektron zum Molekül zurückkehrt, gibt es wieder Energie in Form von Licht ab. Im Experiment haben Wörner und seine Kollegen das Licht der Elektronen gemessen und dadurch detaillierte Informationen über die Elektronenverteilung und deren zeitlicher Entwicklung gewonnen. Diese Informationen offenbaren Details chemischer Reaktionsmechanismen, die bisher so nicht erfasst werden konnten. Das Experiment an NO2 hilft dabei, fundamentale Vorgänge in Molekülen besser zu verstehen und ist eine ideale Ergänzung zu Computersimulationen photochemischer Prozesse. "Unser Experiment ist deshalb so wichtig, weil es theoretische Modelle auf die Probe stellt. Die Erkenntnisse lassen sich unter anderem in der Photochemie anwenden", sagt Wörner. Das immense Interesse an photochemischen Prozessen überrascht nicht, denn diese Forschung soll unter anderem Solarzellen verbessern oder eines Tages künstliche Photosynthese ermöglichen.
Zusatzinformationen:
H. J. Wörner, J. B. Bertrand, B. Fabre, J. Higuet, H. Ruf, A. Dubrouil, S. Patchkovskii, M. Spanner, Y. Mairesse, V. Blanchet, E. Mével, E. Constant, P. B. Corkum, D. M. Villeneuve:
Conical Intersection Dynamics in NO2 Probed by Homodyne High-Harmonic Spectroscopy.
In: Science; Vol. 334 no. 6053 pp. 208-212, 14. Oktober 2011, DOI 10.1126/science.1208664
Quelle: Eidgenössische Technische Hochschule Zürich, ETHZ
Aktualisiert am 14.10.2011.
Permalink: https://www.internetchemie.info/news/2011/oct11/elektronen-bewegung.php
© 1996 - 2024 Internetchemie ChemLin