Sirtuine sind Enzyme, die an der Steuerung von Stoffwechsel- und Alterungsprozessen einen entscheidenden Anteil haben.
Können sie durch pharmakologische Wirkstoffe so beeinflusst werden, dass sie die Therapie schwerer Erkrankungen fördern?
Von besonderem Interesse ist in diesem Zusammenhang eine unter dem Namen Ex-527 bekannte Substanz, die möglicherweise eines Tages zum Beispiel in der Krebsbekämpfung eingesetzt werden könnte. Inzwischen wird die Substanz auch mit dem Namen Selisistat bezeichnet.
Wie die Aktivität von Sirtuinen durch Ex-527 unterdrückt wird, hat jetzt eine Forschungsgruppe um Prof. Dr. Clemens Steegborn an der Universität Bayreuth aufklären können. Im Forschungsmagazin PNAS stellen die Wissenschaftler einen überraschenden Mechanismus vor [vgl. Artikelhinweis unten].
Sirtuine durch Wirkstoffe zielgenau beeinflussen
Im Menschen kommen sieben verschiedene Sirtuine vor, sie werden in der Forschung als "Sirt1" bis "Sirt7" bezeichnet. Indem sie die Strukturen wichtiger Proteine verändern, erzeugen sie wesentliche Signale für zelluläre Prozesse, beispielsweise für die Bildung neuer Proteine auf der Grundlage genetischer Informationen oder für die Anpassung des Nährstoffabbaus. Wirkstoffe, die imstande sind, ein Sirtuin zu aktivieren, bieten deshalb interessante Ansatzpunkte für die Entwicklung von Medikamenten. So könnte etwa eine zielgenaue, unerwünschte Nebenwirkungen ausschließende Aktivierung von Sirt1 ein Weg sein, um Stoffwechselstörungen zu heilen.
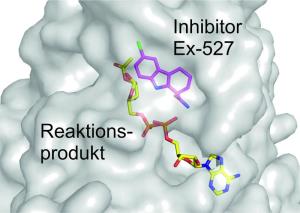
In anderen Fällen wiederum lassen sich therapeutische Effekte möglicherweise dadurch erzielen, dass die Aktivität eines Sirtuins unterdrückt wird. Insbesondere die zielgenaue Hemmung von Sirt1 oder Sirt3 gilt heute in der Forschung als eine ernstzunehmende Perspektive für die Tumorbekämpfung. Eine Substanz, die eine hemmende Wirkung auf Sirtuine hat und insofern als Inhibitor wirkt, ist Ex-527; die exakte Bezeichnung lautet 6-Chloro-2,3,4,9-tetrahydro-1H-carbazol-1-carboxamid.
Wie Sirtuine die eigene Deaktivierung ermöglichen: Ein überraschender Mechanismus legt ihr Aktivitätszentrum lahm
Damit auf der Basis dieser Erkenntnisse geeignete pharmakologische Wirkstoffe entwickelt werden können, ist zuvor eine intensive Grundlagenforschung erforderlich. Vor allem muss der biochemische Mechanismus geklärt sein, durch den Ex-527 die Aktivität von Sirt1 oder Sirt3 unterdrückt. An diesem Punkt ist der Bayreuther Forschungsgruppe um Prof. Dr. Clemens Steegborn in Zusammenarbeit mit Prof. Dr. Mike Schutkowski an der Martin-Luther-Universität Halle-Wittenberg jetzt ein Durchbruch gelungen.
Sirtuine verändern die Strukturen von Proteinen, indem sie an ausgewählten Stellen dieser Moleküle - genauer gesagt: an den Lysingruppen der Proteine - Acetylgruppen abspalten. Dieser Vorgang, die Deacetylierung, wird dadurch eingeleitet, dass drei molekulare Strukturen aufeinander treffen: das Sirtuin, das Protein und eine dritte Substanz namens "NAD+". Ist die Deacetylierung abgeschlossen, sind zwei Produkte entstanden: das Protein, das jetzt eine deacetylierte Lysingruppe enthält, und acetylierte ADP-Ribose (2'-O-acetyl-ADP ribose). Das Sirtuin ist unverändert. Normalerweise fährt es jetzt fort, mit anderen Protein- und NAD+-Molekülen weitere Deacetylierungen in Gang zu setzen.
Doch an genau dieser Fortsetzung wird das Sirtuin von Ex-527 gehindert. Denn indem das Sirtuin eine Deacetylierung bewirkt, schafft es selbst die Voraussetzungen dafür, dass es unmittelbar anschließend von Ex-527 lahmgelegt wird. Ex-527 verbindet sich nämlich einerseits mit dem Sirtuin, andererseits mit der acetylierten ADP-Ribose. Dabei sorgt Ex-527 dafür, dass die acetylierte ADP-Ribose sich an genau der Stelle des Sirtuins festsetzt, wo normalerweise der Kontakt mit einem neuen NAD+-Molekül stattfinden und eine weitere Deacetylierung in Gang gesetzt würde. Hier befindet sich daher das Aktivitätszentrum des Sirtuins. Doch das Sirtuin kann sich nicht von der acetylierten ADP-Ribose befreien, und so ist den nachfolgenden NAD+-Molekülen der Zugang zum Sirtuin versperrt. Das Aktivitätszentrum des Sirtuins bleibt blockiert; es ist nicht imstande, mit der Deacetylierung von Proteinen fortzufahren. So hat sich das Sirtuin gleich beim ersten Mal eine Falle gestellt, in der es gefangen bleibt.
Ex-527 - eine attraktive Substanz für die weitere Wirkstoff-Forschung
Die Bayreuther Biochemiker haben zudem entdeckt, dass Ex-527 seine inhibierende Wirkung auf genau diese und keine andere Weise ausübt. Andere beobachtete Konstellationen - beispielsweise eine Verbindung von Ex-527 mit Sirtuin und NAD+ - sind nicht geeignet, die Aktivität des Sirtuins zu unterbinden. "Unsere Forschungsergebnisse zeigen, dass Ex-527 ein Inhibitor mit einer ungewöhnlichen und zugleich sehr Sirtuin-spezifischen Wirkungsweise ist. Gerade das macht diese Substanz zu einem besonders attraktiven Ansatzpunkt für weitere Untersuchungen", erklärt Prof. Steegborn. "Zudem zeigen unsere Ergebnisse Wege auf, wie die Substanz weiter verbessert werden kann, um gezielt nur die Aktivität eines einzigen Sirtuins zu hemmen." Denn grundsätzlich gilt: Je spezifischer die Wirkungsweise einer Substanz ist, die ein Sirtuin hemmt oder aktiviert, desto besser sind die Aussichten, dass sie als pharmakologischer Wirkstoff infrage kommt. Unüberschaubare Nebenwirkungen müssen von vornherein ausgeschlossen werden können.
Zusatzinformationen:
Melanie Gertz Frank Fischer, Giang Thi Tuyet Nguyen, Mahadevan Lakshminarasimhan, Mike Schutkowski, Michael Weyand, Clemens Steegborn:
Ex-527 inhibits Sirtuins by exploiting their unique NAD+-dependent deacetylation mechanism..
In: Proceedings of the National Academy of Sciences; PNAS, online veröffentlicht am 09. Juli 2013, DOI 10.1073/pnas.1303628110
Quelle: Universität Bayreuth
Aktualisiert am 09.07.2013.
Permalink: https://www.internetchemie.info/news/2013/jul13/ex-527-sirtuin-deaktivierung.php
© 1996 - 2025 Internetchemie ChemLin