Isotope sind Atome desselben Elements mit identischer Protonen-, aber unterschiedlicher Neutronenzahl. Aufgrund unterschiedlicher Massenverhältnisse können Isotopeneffekte die Bildung und den Bruch chemischer Bindungen im Verlauf chemischer Reaktionen maßgeblich beeinflussen. Im Extremfall kann eine Isotopensubstitution sogar eine fundamentale Änderung der Art der chemischen Bindung verursachen, wie Wissenschaftler jetzt in der Zeitschrift Angewandte Chemie berichten [siehe Literatur-Hinweis unten].
Am deutlichsten treten solche Effekt zutage, wenn die Unterschiede zwischen den Isotopen besonders groß sind, wie bei Wasserstoff. In der Natur kommt er als 1H (Protium, H), 2H (Deuterium, D) und 3H (Tritium, T) vor. Weitere Wasserstoff-Isotope wurden künstlich erzeugt, darunter auch exotische Atome, die andere Elementarteilchen enthalten. So besteht z.B. Myonium (Symbol Mu) aus einem Elektron und einem Anti-Myon als Kern. Chemisch verhält es sich wie ein Wasserstoffisotop, ist jedoch um den Faktor 9 leichter als 1H.
Jörn Manz (Shanxi University Taiyuan und FU Berlin), Donald G. Fleming (University of British Columbia, Kanada), Kazuma Sato und Toshiyuki Takayanagi (Saitama University, Japan) führten neuartige quantenchemische ab-initio-Berechnungen der Reaktion zwischen Bromwasserstoff und Bromatomen durch, die zur Bildung des Radikals BrHBr führt. Dabei interessierte sie der Vergleich zwischen den Wasserstoffisotopen H, D, T, Mu sowie eines schweren exotischen Isotops. "Wie sich zeigte, verhalten sich die vier schweren Isotopomere prinzipiell gleich", so Manz. "Das leichteste Isotopomer BrMuBr wird dagegen durch eine vollkommen andere Art der chemischen Bindung zusammengehalten."
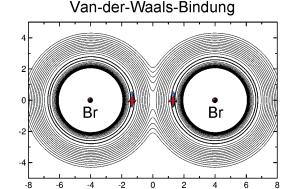
BrHBr und seine schweren Analoga können eine lineare oder eine gewinkelte Form einnehmen. Bei der gewinkelten sind die beiden Bromatome verbunden. Bei der linearen sind beide Bromatome über das H-Atom verbunden, das sich allerdings sehr nah bei einem der beiden Br-Atome aufhält, während das andere wesentlich weiter entfernt ist. Van-der-Waals-Bindungen sorgen für den Zusammenhalt. Sie entstehen durch kurzzeitige Ladungsverschiebungen in einem Teilchen, die anziehend wirken.
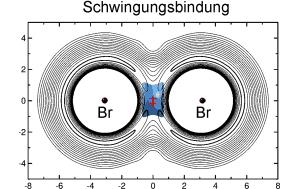
Im Gegensatz dazu wird BrMuBr durch einen erst seit kurzem vermuteten völlig anderen Bindungstyp verbunden, die Schwingungsbindung: Die molekularen Fragmente werden dabei durch ihre Bewegung zusammengehalten. Das Myonium schwingt dabei im Übergangszustand zwischen den beiden Bromatomen. "Unsere Berechnungen zu BrMuBr sind der erste klare Beleg für die Existenz dieses neuen Bindungstyps", so Manz. "Daneben sind sie der erste Nachweis, dass eine Isotopensubstitution die Art der chemischen Bindung fundamental ändern kann. Die verglichenen Isotopomere zeigen völlig verschiedene Strukturen, Symmetrien und vor allem verschiedene Energiebilanzen und Bildungsmechanismen der chemischen Bindungen des untersuchten Radikals."
Über den Autor
Jörn Manz war derzeit Gastprofessor an der Shanxi University Taiyuan und an der Freien Universität Berlin. Sein Hauptarbeitsgebiet ist die Quantenreaktionsdynamik, Grundlage für die Vorhersage der Schwingungsbindung und des neuen Isotopeneffekts, gemeinsam mit seinen Partnern und Koautoren. Manz ist Mitglied der Deutschen Nationalen Akademie der Wissenschaften Leopoldina.
Zusatzinformationen:
Prof. Donald G. Fleming, Prof. Jörn Manz, Kazuma Sato und Prof. Toshiyuki Takayanagi:
Über eine fundamentale Änderung der Art der chemischen Bindung durch Isotopensubstitution.
In: Angewandte Chemie; online veröffentlicht am 10. Oktober 2014, DOI 10.1002/ange.201408211
Quelle: Angewandte Chemie, Pressemitteilung Nr. 38/2014
Aktualisiert am 28.10.2014.
Permalink: https://www.internetchemie.info/news/2014/oct14/Isotopensubstitution-bindungsaenderung.php
© 1996 - 2024 Internetchemie ChemLin