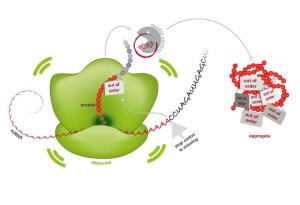
Egal ob bei Alzheimer oder der Huntingtonkrankheit - Proteinverklumpungen gelten als eine Ursache für das Sterben von Nervenzellen. Wie jetzt Forscher vom Max-Planck-Institut für Biochemie in Nature berichten, haben sie einen zellulären Mechanismus entschlüsselt, der das Entstehen der Verklumpungen erklärt. Verloren gegangene Stoppsignale bei der Proteinproduktion führen fälschlicherweise zu langen Lysinketten am Ende der Proteine. So wird das Ribosom, die Proteinfabrik, verstopft. Gesunde Zellen erkennen blockierte Ribosome und bauen nutzlose Proteine zügig ab. Funktioniert die notwendige Qualitätskontrolle nicht, reichern sich fehlerhafte Proteine an und verklumpen zu toxischen Aggregaten.
Um neurodegenerative Krankheiten in Zukunft behandeln zu können, untersucht Forscher Ulrich Hartl, Leiter der Abteilung Zelluläre Biochemie am Max-Planck-Institut für Biochemie, zusammen mit seinem Team seit vielen Jahren die zellulären Ursachen für das Sterben von Nervenzellen. Als eine entscheidende Ursache gelten Proteinverklumpungen - Aggregate aus fehlgefalteten Proteinen. "Wir konnten zeigen, dass die Bildung von Aggregaten begünstigt wird, wenn es Fehler in der Proteinbauanleitung gibt und diese durch die interne Qualitätskontrolle nicht erkannt werden", erklärt Young-Jun Choe, Erstautoren der Studie neben Sae-Hun Park.
In jeder Zelle übernehmen Proteine, wie kleine, molekulare Maschinen, lebenswichtige Funktionen. "Die DNA kann man sich wie eine riesige Bibliothek an Proteinbauanleitungen vorstellen, die sich im Zellkern befinden. Für die Herstellung eines Proteins wird zunächst eine Kopie der Anleitung hergestellt, die mRNA. Diese wird dann aus dem Zellkern an die Ribosomen geleitet die aus Aminosäuren das Protein aufbauen", so Choe.
Die mRNA enthält ein Startsignal, die Information des Proteinaufbaus, ein Stoppsignal und am Ende einen sogenannten Poly-A-Schwanz. Wird der Bauplan beschädigt, beispielsweise durch die Einwirkung von Strahlung oder erbgutverändernden Substanzen, kann es zum Verlust dieses Stoppsignals kommen. Dann kann bei der Proteinherstellung in den Ribosomen das fertige Protein nicht freigesetzt werden. Stattdessen wird der Poly-A-Schwanz als Bauanleitung interpretiert, wodurch zusätzlich Aminosäuren anhängt werden. Die dadurch positiv geladene Lysinkette blockiert die Proteinfabrik und die Herstellung kommt zum Erliegen.
In gesunden Zellen gibt es bei der Proteinherstellung eine sehr effiziente Qualitätskontrolle. Fehlgefaltete und nutzlose Proteine werden markiert, repariert oder zügig abgebaut. Ein wichtiger Bestandteil der Qualitätskontrolle ist Ltn1p. "Ist Ltn1p in krankhaft veränderten Zellen nicht aktiv oder fehlen andere Bestandteile der Qualitätskontrolle, reichern sich fehlerhafte Proteine im Zellinneren an, sie verklumpen", sagt Park.
Welche fatalen Folgen das Versagen der Qualitätskontrolle haben kann, konnte bereits im Mausmodell gezeigt werden. Tiere mit einer entsprechenden Mutation zeigen Symptome von fortschreitender Neurodegeneration und eingeschränkter Bewegungsfähigkeit.
Entstandene Proteinaggregate haben klebrige Eigenschaften und wirken wie ein Kristallisationskeim. Sie binden schließlich auch fehlerfrei funktionierende und für die Zelle lebensnotwendige Proteine an sich. Dies hat zur Folge, dass die Zelle aus dem Gleichgewicht gerät und auf lange Sicht Schaden erleidet. Interessanterweise scheint die Zelle dabei einem bereits bekannten Muster zu folgen, sagt Ulrich Hartl. "Dass die Proteinaggregate auch essenzielle, fehlerfreie Proteine an sich binden, kennen wir bereits aus früheren Studien mit dem Protein Huntingtin, das von selbst aggregiert und im Menschen für die Entstehung der neurodegenerativen Krankheit Chorea Huntington verantwortlich ist."
"Mit unseren Ergebnissen zeigen wir nicht nur einen möglichen Mechanismus zur Entstehung von neurodegenerativen Krankheiten auf, sondern haben zudem ein weiteres Beispiel dafür gefunden, auf welche Weise Proteine zu Aggregaten verklumpen und der Zelle schaden können. Dies bestätigt uns in unserer Vermutung, dass die Unterdrückung des Aggregationsprozesses ein vielversprechender Therapieansatz für eine Vielzahl von heute noch unheilbaren neurodegenerativen Krankheiten darstellt", fasst Hartl die Ergebnisse der Studie zusammen.
Zusatzinformationen:
Young-Jun Choe, Sae-Hun Park, Timm Hassemer, Roman Körner, Lisa Vincenz-Donnelly, Manajit Hayer-Hartl und F. Ulrich Hartl:
Failure of RQC machinery causes protein aggregation and proteotoxic stress.
In: Nature; online erschienen am 29. Februar 2016, DOI 10.1038/nature16973
Quelle: Max-Planck-Institut für Biochemie, Martinsried
Aktualisiert am 02.03.2016.
Permalink: https://www.internetchemie.info/news/2016/mar16/proteinverklumpungen-entstehung.php
© 1996 - 2024 Internetchemie ChemLin