
Bis zu ihrer wissenschaftlichen Wiederentdeckung 2007 an der TU Graz war das im 19. Jahrhundert entdeckte Phänomen Wasserbrücke in Vergessenheit geraten. Wird hochreines, also mehrfach destilliertes Wasser in zwei Behältern unter Hochspannung gesetzt, wandert die Flüssigkeit den Becher entlang nach oben und bildet eine schwebende Wasserbrücke zwischen den Gefäßen. Das Wasser fließt in dieser Brücke in beide Richtungen und ist in einem völlig neuen Zustand mit besonderen Dichte- und Struktureigenschaften.
Eine Forschungsgruppe der TU Graz in Österreich und des niederländischen Forschungszentrums Wetsus hat nun gezeigt, dass diese schwebende Wasserbrücke elektrisch geladenes Wasser erzeugt und diese Ladung zumindest für kurze Zeit speichert.
Protonische elektrische Ladung
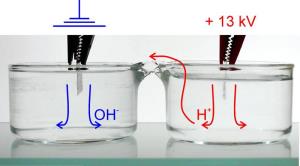
Die Ladung des Wassers ist dabei nicht elektronisch, sondern protonisch. Das neuartige Wasser ist entweder positiv oder negativ geladen, je nachdem ob es mehr oder weniger Protonen enthält. Die Studie zeigt, dass im Anodenwasser - also in jenem Wasser mit anliegender positiver Spannung - im Rahmen der stattfindenden Elektrolyse Protonen gebildet werden. Diese Wasserstoffkerne fließen durch die Wasserbrücke in das Kathodenwasser des anderen, unter negativer Spannung stehenden Bechers und werden dort von Hydroxylionen neutralisiert.
Da sich die Protonen mit endlicher Geschwindigkeit bewegen, herrscht in einem Wasserbehälter immer ein Protonenüberschuss, und im anderen einen Protonenmangel.
Wenn nun die Wasserbrücke plötzlich ausgeschalten wird, bleiben diese Protonen-Ladungen erhalten, wie sich mit Hilfe von Impedanzspektroskopie messen lässt. Erste Untersuchungen haben gezeigt, dass die Ladung der Flüssigkeiten über eine Woche stabil bleibt.
Von der Wasser-Batterie bis zur abfallarmen Chemie
Die Erkenntnis, dass derartige Wasserbrücken als elektrochemische oder biochemische Reaktoren genutzt werden können, eröffnet eine Vielzahl möglicher industrieller Anwendungen. Substanzen können in der Wasserbrücke mit anderen Materialien für chemische Reaktionen in Kontakt gebracht werden, Wasser könnte als Speichermedium für elektrische Ladung zur Wasser-Batterie werden, Säuren und Laugen könnten ohne Gegen-Ionen, also ohne saures oder alkalisches Wasser hergestellt werden.
Das ebnet den Weg zu besonders umweltfreundlichen Reinigungsmitteln, reduziertem Abfall aus chemischen Prozessen und eröffnet neue Möglichkeiten für medizinische Anwendungen.
Zusatzinformationen:
Elmar C. Fuchs, Martina Sammer, Adam D. Wexler, Philipp Kunkte und Jakob Woisetschläger:
A floating water bridge produces water with excess charge.
In: Journal of Physics D: Applied Physics; online erschienen am 23. Februar 2016, DOI 10.1088/0022-3727/49/12/125502
Quelle: Technische Universität Graz, Österreich
Aktualisiert am 01.03.2016.
Permalink: https://www.internetchemie.info/news/2016/mar16/wasserbruecke-batterie.php
© 1996 - 2024 Internetchemie ChemLin