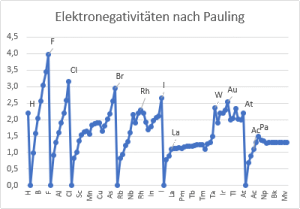
Das Konzept der Elekronegativität wurde von Linus Pauling in der 1930er Jahren eingeführt. Die Elektronegativität Χ eines chemischen Elements ist das in Zahlen ausgedrückte relative Maß für die Tendenz, das Elektronenpaar einer Bindung an sich zu ziehen. Dabei wird der Bindungspartner mit der höheren Elektronegativität als elektronegativ, der mit der geringeren als elektropositiv bezeichnet. Die Elektronegativitätsdifferenz ΔEN läßt Aussagen über Bindungstyp und Reaktion der betrachteten Partner zu.
Neben der relativen, dimensionslosen Elektronegativitätsskala nach Pauling - die immer noch sehr häufig verwendet wird - wurden im Laufe der Zeit mehrere andere Ansätze entwickelt, die die Elektronegativitäten mit quantitativen Methoden betrachten (vgl. nachfolgende Tabelle); berücksichtigt wurden hier die Elektronegativitätswerte nach Allen, Mulliken, Sanderson und Allred-Rochow. Die letzten beiden Spalten enthalten die Werte nach Ghosh-Gupta sowie nach Pearson, jeweils in Elektronenvolt eV.
Linus Pauling berechnete die Elektronegativität anfangs aus den Bindungsenthalpien und erhielt zunächst gerundete Daten [vgl. Spalte 1]. Die resultierenden Werte erwiesen sich jedoch nicht als additive Größen, d.h. zum Beispiel, dass die Bedingung ΔC-F - ΔC-Cl = ΔF-Cl (Δ = Differenz der Elektronegativitäten) nicht erfüllt ist. Nach Pauling wird der Unterschied in der Elektronegativität zwischen den Atomen A und B durch folgende Gleichung ausgedrückt (Ed = Dissoziationsenergien in eV):
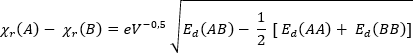
Der Maßstab wurde so gewählt, dass die relative Elektronegativität von Wasserstoff ΧR gleich 2.1 beträgt. Das Vorzeichen der Quadratwurzel wurde von Pauling intuitiv gewählt [11].
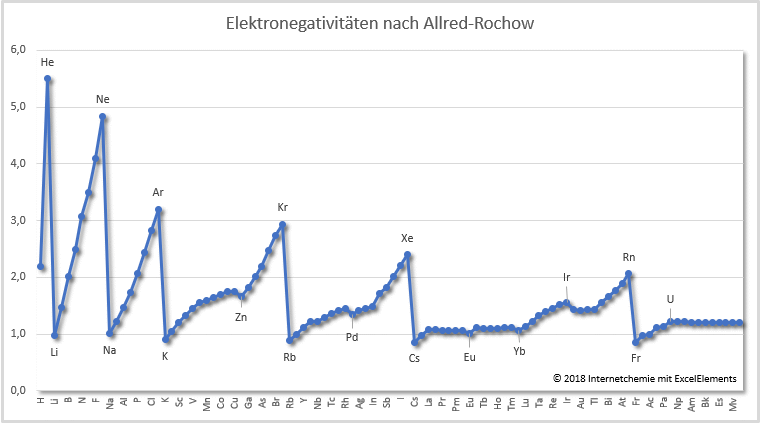
Tabelle: Elektronegativitäten der Elemente
| OZ | Element | Symbol | Pauling orig. | Pauling | Allen | Mulliken | Sander- son | Allred- Rochow |
Ghosh- Gupta [in eV] | Pearson [in eV] |
| [1] | [2] | [3] | [4] | [5] | [6] | [7] | [8] | |||
| 1 | Wasserstoff | H | 2,1 | 2,20 | 2,300 | 2,8 | 2,31 | 2,20 | 7,1862 | 7,18 |
| 2 | Helium | He | 4,160 | 5,50 | 12,0568 | |||||
| 3 | Lithium | Li | 1,0 | 0,98 | 0,912 | 1,3 | 0,86 | 0,97 | 2,4435 | 3,01 |
| 4 | Beryllium | Be | 1,5 | 1,57 | 1,576 | 1,61 | 1,47 | 3,7060 | 4,9 | |
| 5 | Bor | B | 2,0 | 2,04 | 2,051 | 1,8 | 1,88 | 2,01 | 4,9686 | 4,29 |
| 6 | Kohlenstoff | C | 2,5 | 2,55 | 2,544 | 2,5 | 2,47 | 2,50 | 6,2338 | 6,27 |
| 7 | Stickstoff | N | 3,0 | 3,04 | 3,066 | 2,9 | 2,93 | 3,07 | 7,4964 | 7,30 |
| 8 | Sauerstoff | O | 3,5 | 3,44 | 3,610 | 3,0 | 3,46 | 3,50 | 8,7861 | 7,54 |
| 9 | Fluor | F | 4,0 | 3,98 | 4,193 | 4,1 | 3,92 | 4,10 | 10,0378 | 10,41 |
| 10 | Neon | Ne | 4,789 | 4,84 | 11,3003 | |||||
| 11 | Natrium | Na | 0,9 | 0,93 | 0,869 | 1,2 | 0,85 | 1,01 | 2,4380 | 2,85 |
| 12 | Magnesium | Mg | 1,2 | 1,31 | 1,293 | 1,42 | 1,23 | 3,6108 | 3,75 | |
| 13 | Aluminium | Al | 1,5 | 1,61 | 1,613 | 1,4 | 1,54 | 1,47 | 4,6393 | 3,23 |
| 14 | Silicium | Si | 1,8 | 1,9 | 1,916 | 2,0 | 1,74 | 1,74 | 5,5236 | 4,77 |
| 15 | Phosphor | P | 2,1 | 2,19 | 2,253 | 2,3 | 2,16 | 2,06 | 6,3405 | 5,62 |
| 16 | Schwefel | S | 2,5 | 2,58 | 2,589 | 2,5 | 2,66 | 2,44 | 6,8379 | 6,22 |
| 17 | Chlor | Cl | 3,0 | 3,16 | 2,869 | 3,3 | 3,28 | 2,83 | 7,2923 | 8,30 |
| 18 | Argon | Ar | 3,242 | 3,92 | 3,20 | 7,6515 | ||||
| 19 | Kalium | K | 0,8 | 0,82 | 0,734 | 1,1 | 0,74 | 0,91 | 2,0027 | 2,42 |
| 20 | Calcium | Ca | 1,0 | 1,00 | 1,034 | 1,06 | 1,04 | 2,6965 | 2,2 | |
| 21 | Scandium | Sc | 1,3 | 1,36 | 1,19 | 1,09 | 1,20 | 2,8571 | 3,34 | |
| 22 | Titan | Ti | 1,5 | 1,54 | 1,38 | 1,32 | 3,0040 | 3,45 | ||
| 23 | Vanadium | V | 1,6 | 1,63 | 1,53 | 1,45 | 3,1482 | 3,6 | ||
| 24 | Chrom | Cr | 1,6 | 1,66 | 1,65 | 1,56 | 3,2951 | 3,72 | ||
| 25 | Mangan | Mn | 1,5 | 1,55 | 1,75 | 1,60 | 3,4349 | 3,72 | ||
| 26 | Eisen | Fe | 1,8 | 1,83 | 1,80 | 1,64 | 3,5836 | 4,06 | ||
| 27 | Cobalt | Co | 1,8 | 1,88 | 1,84 | 1,70 | 3,7305 | 4,3 | ||
| 28 | Nickel | Ni | 1,8 | 1,91 | 1,88 | 1,75 | 3,8584 | 4,40 | ||
| 29 | Kupfer | Cu | 1,9 | 1,90 | 1,85 | 1,75 | 4,0026 | 4,48 | ||
| 30 | Zink | Zn | 1,6 | 1,65 | 1,59 | 1,86 | 1,66 | 4,1332 | 4,45 | |
| 31 | Gallium | Ga | 1,6 | 1,81 | 1,756 | 1,4 | 2,10 | 1,82 | 4,6638 | 3,2 |
| 32 | Germanium | Ge | 1,8 | 2,01 | 1,994 | 1,9 | 2,31 | 2,02 | 5,1318 | 4,6 |
| 33 | Arsen | As | 2,0 | 2,18 | 2,211 | 2,2 | 2,53 | 2,20 | 5,5372 | 5,3 |
| 34 | Selen | Se | 2,4 | 2,55 | 2,434 | 2,4 | 2,76 | 2,48 | 5,8746 | 5,89 |
| 35 | Brom | Br | 2,8 | 2,96 | 2,685 | 3,0 | 2,96 | 2,74 | 6,1658 | 7,59 |
| 36 | Krypton | Kr | 2,90 | 2,966 | 3,17 | 2,94 | 6,3916 | |||
| 37 | Rubidium | Rb | 0,8 | 0,82 | 0,706 | 1,0 | 0,70 | 0,89 | 2,0135 | 2,34 |
| 38 | Strontium | Sr | 1,0 | 0,95 | 0,963 | 0,96 | 0,99 | 2,5849 | 2,0 | |
| 39 | Yttrium | Y | 1,2 | 1,22 | 1,12 | 1,4 | 0,98 | 1,11 | 2,7237 | 3,19 |
| 40 | Zirconium | Zr | 1,4 | 1,33 | 1,32 | 1,22 | 2,8489 | 3,64 | ||
| 41 | Niob | Nb | 1,6 | 1,60 | 1,41 | 1,23 | 2,9740 | 4,0 | ||
| 42 | Molybdän | Mo | 1,8 | 2,16 | 1,47 | 1,30 | 3,0992 | 3,9 | ||
| 43 | Technetium | Tc | 1,9 | 1,90 | 1,51 | 1,36 | 3,2244 | |||
| 44 | Ruthenium | Ru | 2,2 | 2,20 | 1,54 | 1,42 | 3,3360 | 4,5 | ||
| 45 | Rhodium | Rh | 2,2 | 2,28 | 1,56 | 1,45 | 3,4611 | 4,30 | ||
| 46 | Palladium | Pd | 2,2 | 2,20 | 1,59 | 1,35 | 3,5727 | 4,45 | ||
| 47 | Silber | Ag | 1,9 | 1,93 | 1,87 | 1,42 | 3,6842 | 4,44 | ||
| 48 | Cadmium | Cd | 1,7 | 1,69 | 1,52 | 1,73 | 1,46 | 3,7958 | 4,33 | |
| 49 | Indium | In | 1,7 | 1,78 | 1,656 | 1,3 | 1,88 | 1,49 | 4,253 | 3,1 |
| 50 | Zinn | Sn | 1,8 | 1,96 | 1,824 | 1,8 | 2,02 | 1,72 | 4,672 | 4,30 |
| 51 | Antimon | Sb | 1,9 | 2,05 | 1,984 | 2,0 | 2,19 | 1,82 | 5,0203 | 4,85 |
| 52 | Tellur | Te | 2,1 | 2,10 | 2,158 | 2,2 | 2,34 | 2,01 | 5,3250 | 5,49 |
| 53 | Iod | I | 2,5 | 2,66 | 2,359 | 2,7 | 2,50 | 2,21 | 3,5836 | 6,76 |
| 54 | Xenon | Xe | 2,582 | 2,63 | 2,40 | 5,8121 | ||||
| 55 | Caesium | Cs | 0,7 | 0,79 | 0,659 | 1,0 | 0,69 | 0,86 | 2,18 | |
| 56 | Barium | Ba | 0,9 | 0,89 | 0,881 | 0,93 | 0,97 | 2,4 | ||
| 57 | Lanthan | La | 1,1 | 1,10 | 1,09 | 0,92 | 1,08 | 3,1 | ||
| 58 | Cer | Ce | 1,1 | 1,12 | 1,08 | |||||
| 59 | Praseodym | Pr | 1,1 | 1,13 | 1,07 | |||||
| 60 | Neodym | Nd | 1,1 | 1,14 | 1,07 | |||||
| 61 | Promethium | Pm | 1,1 | 1,13 | 1,07 | |||||
| 62 | Samarium | Sm | 1,1 | 1,17 | 1,07 | |||||
| 63 | Europium | Eu | 1,1 | 1,20 | 1,01 | |||||
| 64 | Gadolinium | Gd | 1,1 | 1,20 | 1,11 | |||||
| 65 | Terbium | Tb | 1,1 | 1,20 | 1,10 | |||||
| 66 | Dysprosium | Dy | 1,1 | 1,22 | 1,10 | |||||
| 67 | Holmium | Ho | 1,1 | 1,23 | 1,10 | |||||
| 68 | Erbium | Er | 1,1 | 1,24 | 1,11 | |||||
| 69 | Thulium | Tm | 1,1 | 1,25 | 1,11 | |||||
| 70 | Ytterbium | Yb | 1,1 | 1,10 | 1,06 | |||||
| 71 | Lutetium | Lu | 1,1 | 1,27 | 1,14 | |||||
| 72 | Hafnium | Hf | 1,3 | 1,30 | 1,16 | 1,23 | 3,8 | |||
| 73 | Tantal | Ta | 1,5 | 1,50 | 1,34 | 1,33 | 4,11 | |||
| 74 | Wolfram | W | 1,7 | 2,36 | 1,47 | 1,40 | 4,40 | |||
| 75 | Rhenium | Re | 1,9 | 1,90 | 1,60 | 1,46 | 4,02 | |||
| 76 | Osmium | Os | 2,2 | 2,20 | 1,65 | 1,52 | 4,9 | |||
| 77 | Iridium | Ir | 2,2 | 2,20 | 1,68 | 1,55 | 5,4 | |||
| 78 | Platin | Pt | 2,2 | 2,28 | 1,72 | 1,44 | 5,6 | |||
| 79 | Gold | Au | 2,4 | 2,54 | 1,92 | 1,42 | 5,77 | |||
| 80 | Quecksilber | Pa | 1,9 | 2,00 | 1,76 | 1,92 | 1,44 | 4,91 | ||
| 81 | Thallium | Tl | 1,8 | 2,04 | 1,789 | 1,96 | 1,44 | 3,2 | ||
| 82 | Blei | Pb | 1,8 | 2,33 | 1,854 | 2,01 | 1,55 | 3,90 | ||
| 83 | Bismut | Bi | 1,9 | 2,02 | 2,01 | 2,06 | 1,67 | 4,69 | ||
| 84 | Polonium | Po | 2,0 | 2,00 | 2,39 | 1,76 | ||||
| 85 | Astat | At | 2,2 | 2,20 | 2,60 | 1,90 | ||||
| 86 | Radon | Rn | 2,06 | |||||||
| 87 | Francium | Fr | 0,7 | 0,70 | 0,86 | |||||
| 88 | Radium | Ra | 0,9 | 0,90 | 0,97 | |||||
| 89 | Actinium | Ac | 1,1 | 1,10 | 1,00 | |||||
| 90 | Thorium | Th | 1,3 | 1,30 | 1,11 | |||||
| 91 | Protactinium | Pa | 1,5 | 1,50 | 1,14 | |||||
| 92 | Uran | U | 1,7 | 1,38 | 1,22 | |||||
| 93 | Neptunium | Np | 1,3 | 1,36 | 1,22 | |||||
| 94 | Plutonium | Pu | 1,3 | 1,28 | 1,22 | |||||
| 95 | Americium | Am | 1,3 | 1,30 | 1,2 | |||||
| 96 | Curium | Cm | 1,3 | 1,30 | 1,2 | |||||
| 97 | Berkelium | Bk | 1,3 | 1,30 | 1,2 | |||||
| 98 | Californium | Cf | 1,3 | 1,30 | 1,2 | |||||
| 99 | Einsteinium | Es | 1,3 | 1,30 | 1,2 | |||||
| 100 | Fermium | Fm | 1,3 | 1,30 | 1,2 | |||||
| 101 | Mendelevium | Md | 1,3 | 1,30 | 1,2 | |||||
| 102 | Nobelium | No | 1,3 | 1,30 | 1,2 | |||||
| 103 | Lawrencium | Lr | 1,3 | 1,30 | ||||||
| 104 | Rutherfordium | Rf | ||||||||
| 105 | Dubnium | Db | ||||||||
| 106 | Seaborgium | Sg | ||||||||
| 107 | Bohrium | Bh | ||||||||
| 108 | Hassium | Hs | ||||||||
| 109 | Meitnerium | Mt | ||||||||
| 110 | Darmstadtium | Ds | ||||||||
| 111 | Roentgenium | Rg | ||||||||
| 112 | Copernicium | Cn | ||||||||
| 113 | Nihonium | Nh | ||||||||
| 114 | Flerovium | Fl | ||||||||
| 115 | Moscovium | Mc | ||||||||
| 116 | Livermorium | Lv | ||||||||
| 117 | Tenness | Ts | ||||||||
| 118 | Oganesson | Og |
Quellen
[1, 2] - Elektronegativitäten nach Pauling
* [1.1] - Linus Pauling: The Nature of the Chemical Bond. IV. The Energy of Single Bonds and the Relative Electronegativity of Atoms. ''Journal of the American Chemical Society'', 1932, DOI 10.1021/ja01348a011.
[3] - Elektronegativitäten nach Allen
* [2] - Leland C. Allen: Electronegativity is the average one-electron energy of the valence-shell electrons in ground-state free atoms. ''Journal of the American Chemical Society'', 1989, DOI 10.1021/ja00207a003.
[4] - Elektronegativitäten nach Mulliken
* [3.1] - A New Electroaffinity Scale; Together with Data on Valence States and on Valence Ionization Potentials and Electron Affinities. ''Journal of Chemical Physics'', 1934, DOI 10.1063/1.1749394.
* [3.2] - Robert S. Mulliken: Electronic Structures of Molecules XI. Electroaffinity, Molecular Orbitals and Dipole Moments. ''Journal of Chemical Physics'', 1935, DOI 10.1063/1.1749731.
[5] - Elektronegativitätsskala nach Sanderson
* [5.1] - R. T. Sanderson: Electronegativity and bond energy. ''Journal of the American Chemical Society'', 1983, DOI 10.1021/ja00346a026.
* [5.2] - R. T. Sanderson: Principles of electronegativity Part I. General nature. ''Journal of Chemical Education'', 1988, DOI 10.1021/ed065p112.
* [5.3] - R. T. Sanderson: Principles of electronegativity Part II. Applications. ''Journal of Chemical Education'', 1988, DOI 10.1021/ed065p227.
* R. T. Sanderson: Polar Covalence. Academic Press, 1983, ISBN 0-12-618080-6.
[6] - Elektronegativitätsskala nach Allred-Rochow
* [6.1] - A.L. Allred, E.G. Rochow: A scale of electronegativity based on electrostatic force. ''Journal of Inorganic and Nuclear Chemistry'', 1958, DOI 10.1016/0022-1902(58)80003-2.
* [6.2] - A.L. Allred: Electronegativity values from thermochemical data.''Journal of Inorganic and Nuclear Chemistry'', 1961, DOI 10.1016/0022-1902(61)80142-5.
[7] - Elektronegativitäts-Skala nach Ghosh und Gupta
* [7.1] - Dulal C. Ghosh, Kartick Gupta: A New Scale Of Electronegativity Of 54 Elements Of Periodic Table Based On Polarizability Of Atoms. ''Journal of Theoretical and Computational Chemistry'', 2006, DOI 10.1142/S0219633606002726.
[8] - Elektronegativitätsskala nach Pearson
* [8.1] - Ralph G. Pearson: Absolute electronegativity and hardness: application to inorganic chemistry, ''Inorganic Chemistry'' (1988), DOI dx.doi.org/10.1021/ic00277a030.
[9] - Smith-Skala [Werte hier nicht abgebildet]
* [9.1] - Derek W. Smith: Electronegativity in two dimensions: Reassessment and resolution of the Pearson-Pauling paradox. ''Journal of Chemical Education'', (1990), DOI 10.1021/ed067p911.
[10] - Elektronegativitäten nach Nagle [Werte hier nicht angegeben]
* [10.1] - Jeffrey K. Nagle: Atomic polarizability and electronegativity. ''Journal of the American Chemical Society'', (1990), DOI 10.1021/ja00168a019.
Weitere Verweise:
* [11] - Electronegativity. Definition, IUPAC Gold Book, DOI 10.1351/goldbook.E01990.
* Linus Pauling (Heinrich Noller): Die Natur der chemischen Bindung, Verlag Chemie 1962, ISBN 3527252177, ISBN 978-3527252176.
Kategorie: Chemische Elemente
Aktualisiert am 02. September 2024.
Permalink: https://www.internetchemie.info/chemische-elemente/elektronegativitaet.php
© 1996 - 2026 Internetchemie ChemLin