|
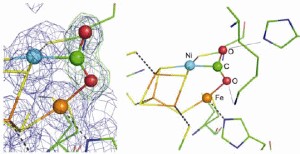
Kohlendioxid gebunden am Ni,Fe-Zentrum der
anaeroben Kohlenmonoxid-Dehydrogenase. Links Modell mit
Elektronendichte, rechts das Strukturmodell.
|
Diese Enzyme sind eine Synthese eines
sulfidischen Minerals mit einem Polypeptid. Wie die komplexen
biologischen Metallzentren ihre gasförmigen Substrate binden und
aktivieren, ist noch weitgehend unbekannt, da Komplexe der
Metalloenzyme mit ihren Substraten meist instabil sind.
Kohlendioxid gebunden am Ni,Fe-Zentrum der anaeroben
Kohlenmonoxid-Dehydrogenase. Links Modell mit Elektronendichte, rechts
das Strukturmodell.
In der neuesten Ausgabe von SCIENCE berichten die Bayreuther
Biochemiker Jae- Hun Jeoung und Holger Dobbek über die Struktur des
Enzyms Kohlenmonoxid- Dehydrogenase im Komplex mit CO2.
Die Kristallstruktur zeigt wie CO2 durch die Bindung an ein
Nickel- und ein Eisen-Ion des Enzyms aktiviert wird. Zwei weitere
Strukturen der Kohlenmonoxid-Dehydrogenase identifizieren die
Bindestelle des Kosubstrates Wasser am Ni, Fe-Zentrum. Im Kontext mit
spektroskopischen Untersuchungen ist es nun möglich einen detailierten
Katalysemechanismus der enzymatischen CO-Oxidation / CO2-Reduktion
(CO + H2O <-> CO2 + 2H+ + 2e-)
zu formulieren.
|