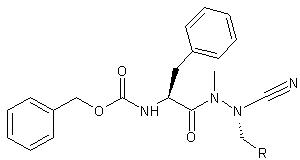
Die Wirkstoffe hemmen im Reagenzglas sehr effektiv bestimmte Enzyme, die so genannten Cysteinproteasen.
Diese spielen bei so unterschiedlichen Krankheiten wie Schlaganfall, Krebs, Malaria oder Osteoporose eine Schlüsselrolle. Die Bonner Forscher berichten in der kommenden Ausgabe des Fachblatts "Angewandte Chemie" (siehe unten) über ihren Erfolg. Der Artikel ist in der Rubrik "Early View" aber schon online abrufbar. Ob die Wirkstoffe oder abgewandelte Formen tatsächlich für den klinischen Einsatz taugen, bleibt abzuwarten.
Cysteinproteasen sind Biokatalysatoren, die Eiweiße spalten können. Viele Viren oder auch die Erreger von Malaria und Bilharziose benötigen diese "Proteinscheren" für den Infektionsprozess. Der Mensch produziert sie jedoch auch selbst. Diese körpereigenen Cysteinproteasen spielen nach heutigen Erkenntnissen bei manchen Krebsarten oder auch der Osteoporose eine wesentliche Rolle.
Pharmaforscher suchen daher in den letzten Jahren verstärkt nach Stoffen, die die Eiweißscheren stumpf werden lassen. Einen Erfolg können nun Dr. Reik Löser, Maxim Frizler und Professor Dr. Michael Gütschow vom Pharmazeutischen Institut der Universität Bonn vermelden: Zusammen mit ihrem Kollegen Dr. Klaus Schilling von der Universität Jena haben sie Substanzen entwickelt, die Cysteinproteasen sehr effektiv an ihrer Arbeit hindern.
"Die von uns konstruierten Hemmstoffe ähneln einem Peptid - das ist im Prinzip ein kleines Protein", erklärt Professor Gütschow. "Sie können daher an das katalytische Zentrum der Proteasen binden. Wir haben aber auf chemischem Wege eine Änderung vorgenommen, so dass sie dort nicht zerlegt werden können." Die Eiweißschere wird so blockiert - und das ziemlich lange: "Unsere Modifikation sorgt dafür, dass die Hemmstoffe eine sehr stabile Bildung mit dem katalytischen Zentrum eingehen."
Die Substanzen zählen zu den so genannten Azadipeptidnitrilen. Die Forscher haben eine ganze Reihe von leicht unterschiedlichen Vertretern dieser Klasse hergestellt. Allen ist gemeinsam, dass sie nur Cysteinproteasen blockieren. Andere Eiweißscheren wie das im Dünndarm tätige Chymotrypsin lassen sie dagegen links liegen. "Andererseits sind unsere Wirkstoffe selbst auch unempfindlich gegen Chymotrypsin", sagt Gütschow. "Sie würden also beispielsweise die Reise durch den Verdauungstrakt unbeschadet überstehen."
Ob sich Vertreter der Azadipeptidnitrile tatsächlich als Medikamente eignen, bleibt abzuwarten. "Wir haben bislang nur im Reagenzglas den Nachweis erbracht, dass sie Cysteinproteasen hemmen", betont der Bonner Pharmaforscher. "Das bedeutet noch längst nicht, dass sie auch im Körper die gewünschte Wirkung erzielen würden. Das war jetzt der erste Schritt auf dem weiten Weg zu einem Medikament, der möglicherweise auch in die Irre führt."
Doch selbst wenn sich Azadipeptidnitrile nicht direkt als Arzneimittel eignen sollten, eröffnen sie der Pharmaforschung neue Perspektiven. Denn um Krankheitsmechanismen aufzuklären, ist die Wissenschaft auf wirksame Hemmstoffe angewiesen. So ergeben sich möglicherweise auf indirektem Wege Ansatzpunkte für neue therapeutische Hebel.
Zusatzinformationen:
Dr. Reik Löser, Maxim Frizler, Dr. Klaus Schilling, Prof. Dr. Michael Gütschow:
Azadipeptidnitrile - hochpotente und proteolysestabile Inhibitoren Papain‐ähnlicher Cysteinproteasen.
In: Angewandte Chemie; erschienen am 16. Mai 2008, DOI 10.1002/ange.200705858
Quelle: Universität Bonn, Pharmazeutisches Institut
Aktualisiert am 23.04.2008.
Permalink: https://www.internetchemie.info/news/2008/apr08/azadipeptidnitrile.php
© 1996 - 2026 Internetchemie ChemLin