|
|
|
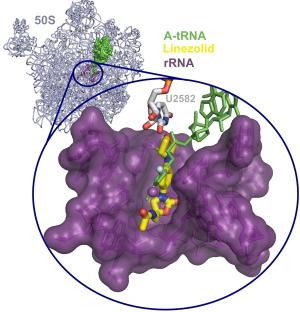
Das Antibiotikum Linezolid (gelb) blockiert die Eiweißproduktion im Ribosom (lila) unerwünschter, krankmachender Bakterien, so dass diese absterben. Bildquelle: Jörg Harms
|
Der Angriffspunkt vieler Antibiotika ist die Protein-Fabrik des Bakteriums, das Ribosom. Dort wird die genetische Information in lebenswichtige Proteine übersetzt. Gerät diese Maschinerie ins Stocken, stirbt das Bakterium ab. Das Antibiotikum Linzezolid greift dabei im "Herz" des Ribosoms, dem Peptidyl-Transferase-Zentrum (PTC), an. Wie die jetzt publizierten dreidimensionalen Röntgenbilder zeigen, bindet das Linezolid dort so an, dass es eine der essentiellen Nukleinsäuren in einer bestimmten Orientierung festhält. Da diese Nukleinsäure eine Schlüsselrolle bei der Knüpfung der Peptidbindung hat, wird damit die Arbeit des PTC im "Herzen" des Ribosoms unterbrochen, wie die Forscher in der aktuellen Ausgabe der Proceedings of the National Academy of Sciences berichten. Zusätzlich blockiert das Antibiotikum die korrekte Bindung der Aminosäure-Lieferanten, der transfer-RNAs (t-RNAs) und damit auch die Verkettung der Aminosäuren. Die bislang widersprüchlichen erscheinenden biochemischen Ergebnisse zu der Frage, wann Oxazolidinon-Antibiotika in den Prozess der Proteinbiosynthese eingreifen, werden damit ebenfalls erklärt. Es stellte sich nämlich heraus, dass die Bindungsstelle des Antibiotikums sowohl in der Initiationsphase als auch kurzzeitig während des Translationszyklus frei ist und somit den Prozess zu unterschiedlichen Zeitpunkten unterbrechen kann. Die Wirkung des Linzezolids besteht also letztlich darin, dass es die Maschine des Lebens in krankmachenden Bakterien lahm legt, indem es verhindert, dass die zum Weiterleben und zur Vervielfältigung wichtigen Proteine produziert werden.
Die
Ludwig-Maximilians-Universität München gibt hierzu bekannt:
Im Kampf gegen multiresistente
Keime
Wie ein Antibiotikum gegen Krankenhauskeime
wirkt.
Als der Wirkstoff Linezolid 2002 für den deutschen
Markt zugelassen wurde, waren die Hoffnungen groß: Zum ersten Mal seit
über 20 Jahren gab es mit dem Vertreter der Oxazolidinone eine
wirklich neue Klasse von Antibiotika. Und erstmals gab es eine Chance,
sogenannten "Superkeimen" in Krankenhäusern und Altenheimen den Garaus
zu machen, die bereits gegen herkömmliche Antibiotika Resistenzen
entwickelt hatten. Sechs Jahre später ist der Wirkstoff noch immer die
letzte Rettung, wenn andere Antibiotika nicht mehr gegen Infektionen
mit Gram-positiven Erregern helfen - etwa bei Lungenentzündungen, aber
auch Infektionen der Haut und weicher Gewebe sowie bei Ansammlungen
von Bakterien im Blut (Bakteriämien), die tödlich enden können. Doch
die Bakterien haben sich als erfinderisch erwiesen: Die ersten
Resistenzen traten bereits auf. "Umso wichtiger ist das Wissen darum,
wie Linezolid genau wirkt, nur so kann das Antibiotikum weiter
verbessert werden", sagt Dr. Daniel Wilson vom Genzentrum der
Ludwig-Maximilians-Universität (LMU) München und dem "Center for
Integrated Protein Science Munich" (CIPSM). Mit Hilfe der
Röntgen-Kristallographie konnte sein Team zusammen mit einer Gruppe um
Professor Paola Fucini von der Universität Frankfurt zeigen, wo
Linezolid im aktiven Zentrum des Ribosoms - die Proteinfabrik der
Zelle - andockt und so die Proteinsynthese der Keime unterbricht. Die
Ergebnisse veröffentlichten die Forscher in der Fachzeitschrift
Proceedings of the National Academy of Science USA (siehe unten).
Um zu überleben und sich zu vermehren besitzt jede
Bakterienzelle Zehntausende von kleinen Proteinfabriken: die Ribosomen.
Ständig lagern sich dort Tausende von Bauteilen zu großen Komplexen,
den Proteinen, zusammen; jede Sekunde verlässt ein neues Protein diese
Produktionsstätte. Das Herzstück der Proteinfabrik ist das
katalytische Zentrum (Peptidyl-Transferase-Centre, PTC). Wie am
Fließband wird hier die Boten-Ribonukleinsäure (mRNA) hindurch
geschleust. Das fadenförmige Molekül hat die in der Erbsubstanz
festgeschriebene Bauanleitung der Proteine in einer Basensequenz
gespeichert und wird nun an zwei Arbeitsplätzen Stück für Stück von
Transfer-Ribonukleinsäuren (tRNA) abgelesen. Dazu dockt eine tRNA
zunächst am Arbeitsplatz A an der für sie passenden Stelle der mRNA
an. Der Proteinbaustein (Aminosäure), den sie transportiert, verbindet
sich daraufhin mit der bereits vorhandenen Kette von Aminosäuren und
verlängert diese. Die tRNA wandert anschließend gemeinsam mit der
Kette zu Arbeitsplatz P, das Fließband bewegt sich eine Stelle weiter.
Dieser Prozess wiederholt sich, bis das Protein fertig gestellt ist.
"Wir konnten zeigen, dass das Antibiotikum
Linezolid einen Teil der Stelle A im katalytischen Zentrum blockiert,
so dass die tRNA dort nicht mehr richtig andocken kann", erklärt
Wilson. Die Folge: es kann keine weitere Aminosäure an die bereits
bestehende Kette angehängt werden, die Proteinsynthese ist
unterbrochen. "Überraschenderweise ist das aber noch nicht alles",
ergänzt Wilson. "Linezolid schafft es gleichzeitig, das gesamte
Ribosom quasi abzuschalten - es hält also nicht nur das Fließband an,
sondern schließt gleich die ganze Fabrik."
Möglich wurde diese Beobachtung durch die
Röntgenstrukturanalyse. Dafür wurden in Linezolid getränkte
bakterielle Ribosomen zunächst kristallisiert und diese
Ribosomen-Kristalle dann Röntgenstrahlen ausgesetzt. Aus dem Muster
der an den Atomen gebeugten Strahlen konnten die Forscher
dreidimensionale Bilder von der Wirkungsweise des Linezolids
errechnen.
Ähnlich wie Linezolid können auch andere
Umwelteinflüsse in einem Ribosom Stress verursachen und das
Weiterlaufen des Fließbandes in der Proteinfabrik stören: Entweder
wird dann eine falsche Aminosäure eingebaut oder das Ribosom ganz lahm
gelegt. Um dies zu verhindern hat das Fließband in den Ribosomen von
Bakterien eine Art Rückspulfunktion, die durch den
Translokationsfaktor LepA in Gang gesetzt wird. So kann im Ribosom ein
weiteres Mal versucht werden, den Prozess der Proteinbildung
entsprechend der vorliegenden Bauanleitung abzuschließen.
Wie die Gruppen um Wilson und Fucini zusammen mit
Forschern um Professor Christian Spahn von der Charité Berlin und
Professor Knud Nierhaus vom Max-Planck-Institut für molekulare Genetik
in Berlin im Fachblatt Nature Structural & Molecular Biology (NSMB)
schreiben, konnten sie in einer zweiten Studie zeigen, wie dieses
Zurückspulen vonstatten geht. Dabei entdeckten sie, dass für den durch
LepA in Gang gesetzten Prozess noch ein weiterer, bisher unbekannter
Platz im Ribosom zur Anlagerung von tRNA verwendet wird. Dieser Platz
kommt noch vor der Stelle A. "Er gleicht dem nicht vollständigen
Andocken der tRNA, wenn Linezolid einen Teil von A blockiert", sagt
Wilson. "Das erklärt auch, warum LepA diejenigen Ribosomen erkennt und
an diese bindet, welche zuvor durch Linezolid lahm gelegt wurden."
|