Einzelne Moleküle nanometergenau an die gewünschte Stelle zu setzen, um daraus komplexe Systeme zu bauen: Das ist ein lang gehegter Traum vieler Wissenschaftler. Denn auf diese Weise könnte man zum Beispiel biologische Prozesse maßgeschneidert ohne lebende Zellen auf einem Chip durchführen. Stefan Kufer und seine Kollegen aus der Arbeitsgruppe von Professor Hermann Gaub, Lehrstuhl für Experimentelle Physik-Biophysik an der Ludwig-Maximilians-Universität (LMU) München, haben diesen Traum nun realisiert. Ihnen gelang es, mit einem Rasterkraftmikroskop (AFM) einzelne Moleküle aus einem Depotbereich aufzunehmen und auf einer Montagefläche nanometergenau wieder abzusetzen. Dabei machten sie sich die Präzision des AFM und die einstellbare Bindungsfähigkeit des DNA-Moleküls zunutze: Abschnitte der Erbinformation wurden zum Greifen und Absetzen der Moleküle verwendet. Die Arbeit im Rahmen des Exzellenzclusters "Nanosystems Initiative Munich" (NIM) wurde in der aktuellen Ausgabe der Fachzeitschrift "Science" veröffentlicht [siehe unten].
Von der Herstellung maßgeschneiderter lebender Zellen mit bestimmten biologischen Funktionalitäten, etwa zur Aufspaltung von Erdöl, ist derzeit oft die Rede. Aber Fachkreise diskutieren seit Jahren auch einen alternativen Konstruktionsansatz für funktionale Nanosysteme. Dabei sollen in einem Rasterkraftmikroskop (AFM) biologische Strukturen aus einzelnen Molekülen Stück für Stück zusammengesetzt werden - verwirklicht wurde diese Idee bisher aber nicht.
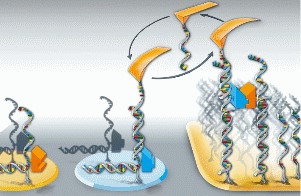
Dabei ist das Grundprinzip zum gezielten Positionieren von Molekülen mittels AFM auf den ersten Blick recht einfach. Man steuert die AFM-Spitze wie einen Kran zu einer Depotfläche und nimmt ein einzelnes Molekül auf. Jetzt muss die Spitze nur noch zu einer Montagefläche bewegt werden, wo man das Molekül wieder absetzen will. Aber genau da tritt nun das entscheidende Problem auf. Es gab bisher bei keinem der in Frage kommenden Greif-Mechanismen eine Möglichkeit zur Trennung des Moleküls von der AFM-Spitze, denn die anziehende Kraft lässt sich nicht einfach abschalten. Das Molekül hängt an der Spitze fest und kann nicht wieder abgesetzt werden.
Dieses als "Sticky Fingers", auf deutsch "klebrige Finger", bezeichnete Problem galt bisher als grundlegendes Hindernis für die Umsetzung einer Molekül-Baukasten-Technik mittels AFM. Die Münchener Forscher haben nun eine Lösung gefunden. Sie machen sich dabei sogar die eigentlich störende Klebrigkeit zunutze, indem sie ein System mit unterschiedlich starken Klebrigkeiten verwenden. Zur Aufnahme des zu versetzenden Moleküls sitzt an seiner Oberseite ein DNA-Abschnitt als eine Art Haken. Ein komplementäres DNA-Stück befindet sich an der Spitze des AFM. Aber auch an der Unterseite wird das Molekül mit einem DNA-Stück verbunden. Und ebenfalls auf der Montage-Fläche, auf der das Molekül abgesetzt werden soll, befinden sich ähnlich wie an der AFM-Spitze DNA-Gegenstücke. Diese binden aber stärker aneinander als die an der Spitze. Wird die Spitze nach dem Absetzen des Moleküls nun nach oben gezogen, so bleibt es auf der Montagefläche haften, löst sich aber von der AFM-Spitze. Die unterschiedlichen Bindungsstärken der DNA-Verbindungen lassen sich durch eine geschickte Wahl der DNA-Längen und der geometrischen Anordnung einstellen.
Zur Überprüfung der neuen Technik haben die Biophysiker auf einem Glasträger räumlich getrennte Depot- und Montageflächen angelegt. Auf den Depotflächen werden verschiedene Arten von Farbstoffmolekülen gelagert. Die Montagefläche ist mit freien DNA-Abschnitten bedeckt, einer Art "DNA-Rasen". Nach der Präparation wird die Probe in einem Rasterkraftmikroskop montiert. Um die Lage der Depots auf der Probe exakt zu vermessen, wird diese von unten mit einem Fluoreszenzmikroskop betrachtet. So lassen sich die Depots anhand der unterschiedlichen Fluoreszenzsignale gut erkennen und für die Manipulation im AFM positionieren. Mit der AFM-Spitze werden dann einzelne Farbstoffmoleküle aus den Depots aufgenommen und auf der Montagefläche gezielt in geometrischen Anordnungen deponiert. Auf diese Weise konnten unter Verwendung einer einzigen Spitze mehrere tausend Moleküle einzeln platziert werden.
Der Biophysiker Stefan Kufer ist sich sicher, mit diesem neuen Verfahren eine "Basis-Technologie" entwickelt zu haben, mit der sich in Zukunft beliebige molekulare Bausteine zu neuen funktionalen Systemen im Nanometerbereich zusammenfügen lassen. So ließen sich durch die bewusste Anordnung von Enzymen auf einem Bio-Chip womöglich komplexe biologische Prozesse auf Einzelmolekülebene mechanisch kontrolliert realisieren, die sonst nur in lebenden Zellen ablaufen können, etwa die Produktion von Insulin oder der Abbau von Schadstoffen.
Professor Hermann Gaub bekräftigt, dass es ihm und seinen Mitarbeitern dank eigener jahrzehntelanger Erfahrung nun gelungen sei, eine "riesige Spielwiese zu schaffen, auf der man seinen Gestaltungswillen ausleben kann." So beschränkt sich die Methode auch nicht auf rein biologische Systeme. Prinzipiell sollten sich sogar Strukturen aus der Informationstechnologie auf diese Weise zusammensetzen lassen, etwa Quantenpunkte oder winzige Magnetstrukturen. "An die DNA kann man anhängen, wozu man Lust hat", schwärmt Gaub.
Die Arbeit, die in der aktuellen Ausgabe von "Science" veröffentlicht wurde, fand im Rahmen des Exzellenzclusters "Nanosystems Initiative Munich (NIM)" statt, das es sich zum Ziel gesetzt hat, funktionale Nanostrukturen für Anwendungen in der Medizin und in der Informationsverarbeitung zu entwickeln und zu erforschen.
Zusatzinformationen:
S. K. Kufer, E. M. Puchner, H. Gumpp, T. Liedl, H. E. Gaub:
Single-Molecule Cut-and-Paste Surface Assembly.
In: Science; veröffentlicht am 01. Februar 2008, DOI 10.1126/science.1151424
Quelle: Nanosystems Initiative Munich
Aktualisiert am 01.02.2008.
Permalink: https://www.internetchemie.info/news/2008/feb08/molekül-baukasten-im-rasterkraftmikroskop.php
© 1996 - 2026 Internetchemie ChemLin