Gips wurde schon in der Antike als Baumaterial verwendet und ist auch heute breit im Einsatz als Bindemittel in Putz, Estrich und Spachtelmassen. Gips, in der Bauchemie meist Dihydrat genannt, ist ein wasserhaltiges Calciumsulfat (CaSO4 × 2H2O). In verschiedenen Brennverfahren wird ihm ein Teil des Kristallwassers entzogen, es entsteht gebrannter Gips oder Halbhydrat (CaSO4 × 0,5H2O). Beim Anrühren mit Wasser nimmt es das verlorene Kristallwasser wieder auf und bindet dabei ab. Die Struktur und der exakte Wassergehalt des Halbhydrats sorgten bis heute für Spekulationen. Michael F. Bräu (BASF Construction Chemicals GmbH und Horst Weiss (BASF SE) dürften diese nunmehr beendet haben: Mit Einkristallstrukturanalysen konnten sie die Struktur knacken, ein Strukturmodell aufstellen und durch Computerberechnungen untermauern. Wie sie in der Zeitschrift Angewandte Chemie berichten, enthält das Halbhydrat in der Tat pro Formeleinheit genau ein halbes Wassermolekül - fest an das Calciumsulfatgerüst koordiniert.
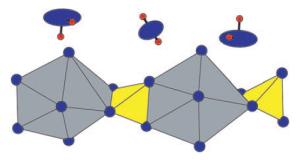
Halbhydrat ist die weltweit in der größten Menge hergestellte anorganische Verbindung, daher sind die Struktur und der Wassergehalt von enormem wirtschaftlichem und wissenschaftlichem Interesse. Bereits 1933 wurde ein erstes, bis heute gültiges Strukturmodell vorgeschlagen. Inzwischen gibt es eine Vielzahl von verfeinerten Modellen. Die Calciumsulfat-Basisstruktur wird damit gut wiedergegeben. Uneinig war man sich bisher jedoch, ob die Wassermoleküle in der Struktur ebenfalls eine definierte Anordnung haben - und wenn ja, wie diese aussieht.
Um solche Fragen zu klären, sind Strukturanalysen notwendig, die auf Röntgenbeugungsexperimenten an Einkristallen ausreichender Größe und Qualität beruhen. Die Atome eines Kristalls lenken eingestrahlte Röntgenstrahlen ab. Aus dem erzielten charakteristischen Beugungsmuster lassen sich die Positionen der einzelnen Atome in einem Kristall errechnen. Dies gestaltete sich im Fall der Gipskristalle bisher allerdings sehr schwierig. Bräu und Weiss waren nun erfolgreich. Mit Tricks und Kniffen gelang es ihnen, die Beugungsmuster auszuwerten und mit ihren Computerberechnungen zu einem plausiblen Strukturmodell zusammenzuführen. Die Ausrichtungen der einzelnen Wassermoleküle und ihre Abstände untereinander belegen, dass sie in keinerlei gegenseitiger Wechselwirkung stehen, sondern an das Calciumsulfatgitter gebunden sind. Sie sind bereits so eng angeordnet, dass sich keine weiteren Wassermoleküle in die Kanälchen der Basisstruktur einfügen lassen. Kristallvarianten mit einem Anteil an Kristallwasser oberhalb von 0,5 pro Formeleinheit erscheinen daher als sehr unwahrscheinlich.
Zusatzinformationen:
Dr. Horst Weiss, Dr. Michael F. Bräu:
Wie viel Wasser enthält gebrannter Gips.
In: Angewandte Chemie; online veröffentlicht am 06. April 2009, DOI 10.1002/ange.200900726
Quelle: Angewandte Chemie, Pressemitteilung Nr. 14/2009
Aktualisiert am 20.04.2009.
Permalink: https://www.internetchemie.info/news/2009/apr09/wassergehalt-von-gips.php
© 1996 - 2026 Internetchemie ChemLin