Mehr als die Hälfte aller menschlichen Proteine, aber auch viele wichtige Pharma-Wirkstoffe sind Glycoproteine, das heißt sie tragen Zuckerbausteine. Natürliche Glycoproteine haben in der Regel keinen einheitlichen Zuckerteil. Mit heutigen Reinigungsverfahren ist es praktisch unmöglich, ausreichende Mengen einheitlicher Glycoproteine für systematische biomedizinische Studien zu isolieren. Ein Nachbau im Labor ist eine gute Alternative - aber auch eine sehr komplexe Aufgabe. Wie Wissenschaftler um Carlo Unverzagt von der Universität Bayreuth in der Zeitschrift Angewandte Chemie berichten, ist es ihnen jetzt gelungen, Ribonuclease C (RNase C), ein glycosyliertes Enyzm aus dem Rinderpankreas, mit einer neuen Synthesestrategie nachzubauen.
Zuckerbausteine spielen eine wichtige Rolle für die Wasserlöslichkeit, die Stabilität und die Faltung von Glycoproteinen. Außerdem sind sie an molekularen Erkennungsvorgängen, z.B. bei der Zelladhäsion oder der Wechselwirkung von Wirtszellen mit Pathogenen, entscheidend beteiligt. Dabei kann das gleiche Protein mit verschiedenen Zuckereinheiten unterschiedliche Funktionen haben. Auch die RNase ist ein Enzym, das in verschieden glycosylierten Formen vorliegt. Als bisher am intensivsten untersuchtes Enzym ist sie ein interessantes Modellsystem für die Forschung. RNase-Version C trägt einen komplexen Zuckerteil in Form einer zweiendigen "Antenne".
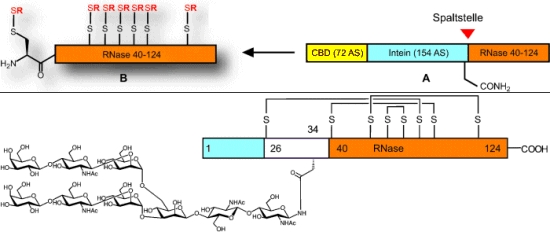
Die konventionelle Festphasensynthese, bei der ein Peptid Aminosäure für Aminosäure aufgebaut wird, ist für lange Peptidketten viel zu aufwändig und klappt aufgrund von Nebenreaktionen zuweilen auch gar nicht. Unverzagt und sein Team bauten die RNase C daher sequenziell aus mehreren Fragmenten auf, die sie am Ende durch "native chemische Ligation" verknüpften. Ein Peptidfragment wird dazu über eine Thioestergruppe mit der endständigen Cysteingruppe (schwefelhaltige Aminosäure) eines zweiten Peptidfragments verknüpft - eine selektive Reaktion, bei der eine natürliche Peptidbindung entsteht.
Das kritische Peptidfragment, nämlich das mit der Zuckerantenne, stellten die Forscher chemisch per Festphasensynthese her. Ein weiteres Fragment wurde bakteriell mittels einer vom Proteinspleißen abgeleiteten Technik gewonnen. Aus einem in einer Zellkultur produzierten Fusionsprotein spaltet sich dabei autokatalytisch eine Proteinsequenz (Intein) ab. Besonders schwierig: Das freiwerdende Proteinfragment enthält außer der endständigen Cysteingruppe sieben weitere Cysteine. Deren Schwefel-Wasserstoffgruppen sind äußerst reaktiv und oxidationsempfindlich. Um sie zu schützen, wurden sie in Form gemischter Disulfide "abgekapselt". Diese Schutzgruppen lassen sich anschließend leicht wieder entfernen.
Dank ausgefeilter Techniken gelang es dem Team schließlich, die einzelnen Fragmente korrekt zu verknüpfen, das Enzym in die natürliche Form zu falten und die Schwefelatome der Cysteine in der richtigen Weise zu Disulfidbrücken zu verkuppeln, so dass eine funktionstüchtige RNase C entstand.
Zusatzinformationen:
Christian Piontek, Dr., Petra Ring, Olaf Harjes, Christian Heinlein, Stefano Mezzato, Dr., Nelson Lombana, Claudia Pöhner, Markus Püttner, Dr., Daniel Varon Silva, Dr., Andreas Martin, Dr., Franz Xaver Schmid, Prof., Carlo Unverzagt, Prof.:
Semisynthese eines homogenen Glycoprotein-Enzyms: Ribonuclease C (Teil 1).
In: Angewandte Chemie; veröffentlicht am 28. Januar 2009, DOI 10.1002/ange.200804734
Quelle: Bildquelle: Angewandte Chemie, Pressemitteilung Nr. 04/2009,
Aktualisiert am 30.01.2009.
Permalink: https://www.internetchemie.info/news/2009/jan09/semisynthese-einheitlicher-glycoproteine.php
© 1996 - 2026 Internetchemie ChemLin