|
|
|
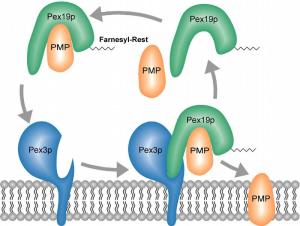
Peroxisomale Membranproteine (PMPs) werden an freien Ribosomen in der Zellflüssigkeit hergestellt und nach ihrer Fertigstellung in die peroxisomale Membran eingebaut. Hierfür dient Pex19p als löslicher Rezeptor, der die PMPs erkennt, bindet und an die Membran geleitet. An der Membran dient Pex3p als Andockpartner. Der Farnesylrest ist für Pex19p dabei von entscheidender Bedeutung.
[Bildquelle: RUB]
|
Grundlage für die Behandlung von Krankheiten Peroxisomen spielen eine entscheidende Rolle bei verschiedensten Stoffwechselprozessen. Sie enthalten eine Vielzahl von Enzymen, die an der Entgiftung der Zelle sowie an der Oxidation von Fettsäuren und anderen wichtigen Prozessen beteiligt sind. Störungen in der Funktion oder Entstehung der Peroxisomen führen zu schweren zumeist tödlichen Erkrankungen. Die Bochumer Arbeitsgruppe hat sich zum Ziel gesetzt, die molekularen Prozesse der Herstellung der Peroxisomen zu entschlüsseln. Dieses Verständnis ist die Grundlage zur Entwicklung von Therapieansätzen zur Behandlung von peroxisomalen Erkrankungen. Mission: Erkennen und abschleppen Ein Aspekt der Herstellung von Peroxisomen ist die Biogenese ihrer Membran. Die Membran, eine Lipidschicht, die die äußere Hülle des Peroxisoms bildet, enthält verschiedene Proteine, die an anderer Stelle hergestellt und dann in die Membran importiert werden. Für den Transport der neu erstellten Membranproteine zum Peroxisom spielt das Protein Pex19p eine entscheidende Rolle. Es fungiert als Rezeptor für die zu importierenden Membranproteine. Dabei erkennt Pex19p die Zielproteine über spezielle Erkennungssequenzen, bindet diese und geleitet sie zur peroxisomalen Membran. Welchen Sinn hat der Lipidrest? Eine Besonderheit von Pex19p ist eine Modifikation, welche nach der Herstellung des Proteins stattfindet. Bei dieser Modifikation handelt es sich um eine so genannte Farnesylierung. Dabei wird ein Lipidrest (Farnesyl) an ein Ende des Proteins angehängt. Bei den meisten Proteinen trägt diese Modifikation dazu bei, die Proteine in einer Membran zu verankern. Ihre Funktion im Fall von Pex19p war aber unklar. Die Aufgabe für die Forscher bestand nun darin, die Funktion dieses Lipidrestes von Pex19p aufzuklären. Mutante funktioniert nicht Sie überprüften zunächst, welche Auswirkung ein Fehlen der Modifikation auf die Biogenese von Peroxisomen hat. Über molekularbiologische Techniken konnten sie Proteinvarianten erstellen, welche sich durch ein Fehlen des Farnesylrestes auszeichneten. Mit diesen Mutanten war der Nachweis möglich, dass die Entstehung von Peroxisomen deutlich gestört war. Ebenso zeigte sich, dass essentielle Membranproteine instabil waren, was in dem Ausfall wichtiger Proteinkomplexe der Peroxisomen resultierte. Die Farnesylierung von Pex19p ist also ein wesentlicher und wichtiger Bestandteil von Pex19p.
Faltung und Anbindung sind gestört In weiteren Studien untersuchten die Forscher noch, welches die molekularen Ursachen für die Biogenesestörungen sind. Eine Störung der Anbindung an die peroxisomale Membran konnte nach ersten Experimenten ausgeschlossen werden. Damit war klar, dass die Farnesylierung für Pex19p nicht der Membrananbindung dient, sondern eine anscheinend neue Funktion hat. Über biochemische und biophysikalische Techniken ließ sich letztlich zeigen, dass die Bindung zwischen Pex19p und den zu transportierenden Proteinen 10-mal stärker wird, wenn Pex19p modifiziert ist. In strukturellen Untersuchungen zeigte sich schließlich darüber hinaus, dass der Farnesylrest für eine korrekte Faltung des Proteins und somit auch für die korrekte Funktion des Proteins von entscheidender Bedeutung ist.
|