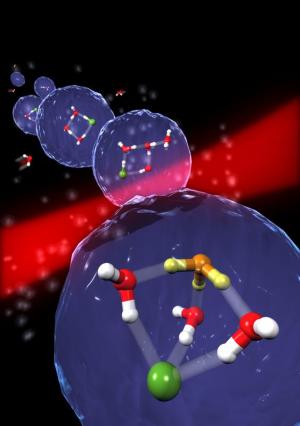
Genau vier Wassermoleküle sind notwendig, um mit Chlorwasserstoff den kleinstmöglichen Tropfen Säure zu erzeugen. Diese Erkenntnis haben die Arbeitsgruppen von Prof. Dr. Martina Havenith-Newen (Physikalische Chemie) und Prof. Dr. Dominik Marx (Theoretische Chemie) im Rahmen der RUB-Forschergruppe 618 gewonnen. Sie führten dazu Experimente bei ultrakalten Temperaturen nahe dem absoluten Nullpunkt durch, wobei sie die Moleküle mit Infrarotlaserspektroskopie beobachteten, und setzten parallel auf theoretische Berechnungen, sog. ab initio Simulationen.
Diese Reaktion bei eisiger Kälte ist ihren Berechnungen zufolge nur dann möglich, wenn ein Molekül nach dem anderen einzeln hinzugefügt wird. Ihre Ergebnisse wurden als "Highlight-Artikel" in der einer Ausgabe des Magazins Science veröffentlicht [siehe unten].
Chemie bei eisiger Kälte im All
Gibt man eine klassische Säure wie z.B. Chlorwasserstoff (HCl) in Wasser, so spaltet das Säuremolekül bevorzugt ein Proton (H+) ab. Dadurch sinkt der pH-Wert der Lösung stark ab, die Lösung wird also "sauer". Insbesondere bilden sich durch Zusammenlagerung der abgespaltenen Protonen mit Wassermolekülen so genannte Hydroniumionen (H3O+), die dann für eine Vielzahl weiterer Reaktionen im wässrigen Medium zur Verfügung stehen. Zwar ist diese Reaktion eine der zentralen Reaktionen der Chemie in wässriger Lösung. Bisher war aber offen, wie viele Wassermoleküle mindestens benötigt werden, um diese Trennung in ein negatives Ion Cl- und ein positives Ion H3O+ zu ermöglichen. "Während wir alle Säuren aus dem Alltag kennen, haben wir jetzt erstmals auf molekularer Ebene Säurebildung direkt beobachtet. Dieses Wissen brauchen wir auch, um chemische Prozesse in nanoskopischen Strukturen, auf kleinen Partikeln oder auf Oberflächen verstehen zu können", erklärt Prof. Havenith-Newen. Zudem gibt es eine reichhaltige Chemie auch bei sehr tiefen Temperaturen - eine zentrale Grundlage für Reaktionen auf stratosphärischen Wolken oder im interstellaren Medium. Es war aber offen, wie Reaktionen mit ganz wenigen Wassermolekülen bei ultrakalten Temperaturen überhaupt stattfinden können.
Ultrakalte Falle
Um dies experimentell untersuchen zu können, lagerten die Forscher sowohl Chlorwasserstoff als auch einzelne Wassermoleküle sukzessiv in eine besondere kalte Falle ein. Dazu verwendeten sie Tröpfchen von supraflüssigem Helium, die eine Temperatur von weniger als -272,8 °C haben. In diesem Tröpfchen werden die einzelnen Moleküle erst gekühlt, bevor sie miteinander reagieren. "Supraflüssig" ist dabei eine spezielle Eigenschaft des Heliums, die bedeutet, dass sich die eingelagerten Moleküle reibungslos darin weiterbewegen können, obwohl sie eigentlich "festgefroren" sein müssten. Dadurch ist eine Beobachtung mit bisher nicht erreichter Präzision möglich: So eingefangen lässt sich der 'Fingerabdruck' der Säuremoleküle - ihr Infrarotspektrum - genau beobachten. Durch eine Kombination dieser Einlagerungstechnik mit hochauflösender Infrarotlaserspektroskopie und theoretischen Berechnungen konnten die Chemiker zeigen, dass genau vier Wassermoleküle ausreichen, um mit HCl den kleinsten Tropfen Säure, (H3O)+(H2O)3Cl-, zu bilden.
Wichtig: Ein Molekül nach dem anderen hinzufügen
Nachdem der Nachweis erbracht war, stellte sich allerdings noch die Frage, wie diese Reaktion überhaupt so nahe am absoluten Temperaturnullpunkt stattfinden kann. "Normalerweise müssen chemische Reaktionen durch Zufuhr von Wärme aktiviert werden, genauso wie beim Kochen zu Hause durch eine Heizplatte oder Gasflamme", erläutert Prof. Marx. "Wie soll das aber bei weniger als einem Kelvin möglich sein?" Hier zeigten die Rechnungen im Zusammenspiel mit dem Experiment, dass die Reaktion erst durch den schrittweisen Prozess der Anlagerung selbst ermöglicht wird. Statt also das HCl-Molekül und alle vier Wassermoleküle gleichzeitig zusammenzugeben und dann abzuwarten, beobachtet man in der Simulation, dass bei der schrittweisen Zugabe von einem Wassermolekül nach dem anderen genau bei Hinzufügen des vierten Wassermoleküls die Säure HCl ein Proton abgibt. Dies bildet dann sofort mit einem der vier Wassermoleküle ein Hydroniumion. Dieser unübliche Mechanismus wurde auf den Namen "aggregationsinduzierte Dissoziation" getauft. "Wir vermuten, dass solche 'aggregationsinduzierten Reaktionen' chemische Umwandlungen bei ultrakalten Bedingungen erklären, wie sie z.B. auf winzigsten Eispartikeln in Wolken oder im interstellarem Medium herrschen", so Prof. Marx.
Förderung durch die DFG
Die dieser Publikation zugrunde liegenden Arbeiten sind Teil der Forschergruppe 618 "Die Aggregation kleiner Moleküle mit präzisen Methoden verstehen - Experiment und Theorie im Wechselspiel" (Sprecher: Prof. Dr. Wolfram Sander, Fakultät für Chemie und Biochemie der RUB), die von der Deutschen Forschungsgemeinschaft (DFG) gefördert wird und gerade nach erfolgreicher Begutachtung verlängert wurde.
Zusatzinformationen:
Anna Gutberlet, Gerhard Schwaab, Özgür Birer, Marco Masia, Anna Kaczmarek, Harald Forbert, Martina Havenith, Dominik Marx:
Aggregation-Induced Dissociation of HCl(H2O)4 Below 1 K: The Smallest Droplet of Acid.
In: Science; Vol. 324. no. 5934, pp. 1545 - 1548, 19 Juni 2009, DOI 10.1126/science.1171753
Quelle: Ruhr-Universität, Bochum
Aktualisiert am 19.06.2009.
Permalink: https://www.internetchemie.info/news/2009/jun09/aggregationsinduzierte-dissoziation.php
© 1996 - 2026 Internetchemie ChemLin