Eine neue Studie deckt nun die komplexen Zusammenhänge in der Sauerstoffminimumzone des tropischen Südostpazifiks auf.
In Folge der globalen Erwärmung dehnen sich Regionen sauerstoffarmen Wassers - so genannte Sauerstoffminimumzonen - in den Weltmeeren immer weiter aus. Das hat weitreichende Auswirkungen auf den Lebensraum Meer und die Fischereiwirtschaft, da höhere Organismen diese Regionen meiden. Auch die globalen Kreisläufe von Kohlenstoff und Stickstoff sind eng mit Sauerstoffminimumzonen verknüpft.
Ein detailliertes Verständnis dieser Kreisläufe ist daher unverzichtbar, um die Auswirkungen des fortschreitenden Klimawandels auf die Weltmeere und mögliche Rückkopplungen vorherzusagen. Eine im Fachjournal PNAS der Amerikanischen Akademie der Wissenschaften erschienene Studie unter der Leitung von Phyllis Lam vom Max-Planck-Insitut für Marine Mikrobiologie in Bremen bringt uns diesem Verständnis einen großen Schritt näher.
Die Forscher beschäftigten sich mit dem Stickstoffkreislauf im tropischen Südostpazifik rund um die peruanische Sauerstoffminimumzone. Diese Region ist eine von drei Meeresregionen, in denen Stickstoff aus dem Meerwasser entweicht. "Lange Zeit wurde dieser Verlust auf Denitrifizierung zurückgeführt. Dabei wird Nitrat in Luftstickstoff umgewandelt, der dann in die Atmosphäre entweichen kann", erklärt Lam. "Dieses Bild wandelt sich allerdings: Scheinbar sind so genannte Anammox-Bakterien für den Großteil des "verlorenen" Stickstoffs verantwortlich. Bisher war jedoch unklar, woher die Anammox-Bakterien die "Rohstoffe" für diese Umwandlung nehmen." Zudem ist im Untersuchungsgebiet keine Denitrifizierung messbar. Das stellt unser Verständnis vom eng verbundenen Kohlenstoffkreislauf in Frage - wenn es nicht die Denitrifizierung ist, welcher Prozess verantworte dann in sauerstoffarmen Wasserkörpern den Abbau organischen Materials?
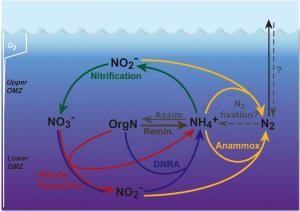
Lams Erkenntnisse erschüttern bisherige Annahmen über den Stickstoffkreislauf in der peruanischen Sauerstoffminimumzone. Sowohl Experimente als auch molekulare Untersuchungen deuten darauf hin, dass mehrere Prozesse (mit Bezeichnungen, die den Laien durchaus fordern) beteiligt sind (Abb. 1): Der Großteil des Stickstoffs geht tatsächlich durch Anammox verloren. Dies ist unmittelbar an die Nitratreduktion und aerobe Ammoniakoxidation (den ersten Schritt der Nitrifizierung) als Quellen des NO2- gekoppelt. Das erforderliche NH4+ wiederum stammt aus der dissimilatorischen Nitratreduktion (DNRA) und Remineralisierung von organischem Material durch Nitratreduktion und vermutlich mikroaerobe Respiration. Die Bedeutung der einzelnen Prozesse variiert zwischen Küstenregionen und dem offenen Ozean ebenso wie in unterschiedlichen Tiefenschichten der Sauerstoffminimumzone. Zudem erstaunten die Forscher die hohen Umsatzraten der DNRA - bisher vermutete man, dass dieser Prozess im offenen Ozean keine Rolle spielt.
Mit ihren Erkenntnissen stürzen die Bremer Forscher die vorherrschende Meinung, dass Nitrat aus der Tiefsee für den gesamten Stickstoffverlust des Ozeans verantwortlich ist. Dessen Anteil betrug ersten Abschätzungen zufolge nur etwa die Hälfte, während die restlichen Verluste aus remineralisiertem Stickstoff - also solchem, der aus organischem Material stammte - erwuchsen.
Bisherige Berechnungen des Stickstoffverlusts, die sich alleine auf Messungen des Nitratdefizits berufen, unterschätzen den tatsächlichen Verlust aus dem Ozean also vermutlich substantiell - gerade wenn die Ergebnisse auf die anderen Sauerstoffminimumzonen der Welt übertragbar sind. "Insbesondere die Rolle des remineralisierten Stickstoffs muss überdacht werden", betont Lam. "Nur so werden verlässliche Vorhersagen über die zukünftige Rolle der Ozeane für das Weltklima möglich."
Der Stickstoffkreislauf im Meer
Alles Leben auf der Erde hängt vom Stickstoff ab, denn er ist unverzichtbar für Zellbestandteile wie Proteine und die DNA. Die Organismen können jedoch nicht alle Verbindungen dieses Elements nutzen. Daher bestimmt im Ozean nur ein Teil der Stickstoffverbindungen die Produktivität des gesamten Ökosystems. Die Umwandlung einer Verbindung in eine andere übernehmen spezialisierte Mikroorganismen.
Im Ozean wird Stickstoff in Form von Ammonium (NH4+) hauptsächlich durch den Abbau organischer Verbindungen frei gesetzt. In einem zentralen Schritt, bekannt als Nitrifizierung, wird Ammonium in Nitrit (NO2-) und dann in Nitrat (NO3-) umgewandelt. Dieser Prozess verbraucht Sauerstoff. Das Nitrat wird anschließend ohne Sauerstoff in mehreren Zwischenschritten in gasförmigen elementaren Stickstoff (Luftstickstoff, N2) umgewandelt. Diese Reaktion nennt sich Denitrifizierung. Alle Umwandlungen werden durch Mikroorganismen vermittelt. Das N2 entweicht als Gas aus dem Meer. Vor ein paar Jahren entdeckten Forscher vom Bremer Max-Planck-Institut den Prozess der anaeroben Oxidation von Ammonium (ANAMMOX) im Meer. Unter sauerstofffreien Bedingungen wandeln Anammox-Bakterien Ammonium direkt mit Nitrit in gasförmigen Stickstoff (N2).
Sauerstoffminimumzonen
Die Sauerstoffminimumzone ist eine Wasserschicht mit sehr geringem Sauerstoffgehalt, üblicherweise in 200 bis 1000 m Wassertiefe. Zwar machen die sauerstoffarmen Wassermassen nur etwa 0,1% des Meeresvolumens aus, dennoch sind sie für 20-40% des Stickstoffverlusts verantwortlich.
Die Methoden
Lam und ihre Kollegen nutzten für ihre Analyse das stabile Stickstoff-Isotop 15N. Das ermöglicht die detaillierte Untersuchung einzelner Stoffumwandlungen. Zudem analysierten sie die parallele Genexpression der anwesenden Organismen - wenn diese die zellinterne Maschinerie zum Bau der notwendigen Enzyme anwerfen.
[Fanni Aspetsberger]
Zusatzinformationen:
Phyllis Lam, Gaute Lavik, Marlene M. Jensen, Jack van de Vossenberg, Markus Schmid, Dagmar Woebken, Dimitri Gutiérrez, Rudolf Amann, Mike S. M. Jetten and Marcel M. M. Kuypers:
Revising the nitrogen cycle in the Peruvian oxygen minimum zone.
In: Proceedings of the National Academy of Sciences; PNAS, online veröffentlicht am 02. März 2009, DOI 10.1073/pnas.0812444106
Quelle: Max-Planck-Institut für marine Mikrobiologie, MPI Bremen
Aktualisiert am 03.03.2009.
Permalink: https://www.internetchemie.info/news/2009/mar09/ozean-stickstoff-kreislauf.php
© 1996 - 2026 Internetchemie ChemLin