Proteine sind die molekularen Maschinen in unseren Zellen. Um ihre Funktionsweise verstehen zu können, muss man die bei ihrer Arbeit ablaufenden Veränderungen auf einem molekularen Niveau verfolgen können. Dies ist möglich mithilfe von Infrarotspektroskopie, speziell der so genannten Fourier-Transform Infrarot (FTIR) Spektroskopie, die die Schwingungen der einzelnen chemischen Bindungen in einem Protein und deren Veränderungen während der Arbeit des Proteins messen kann.
Ein FTIR-Spektrum eines typischen Proteins setzt sich jedoch aus mehreren tausend Schwingungen zusammen, die sich gegenseitig überlagern, so dass es mühsam und oft unmöglich ist, die interessierenden Schwingungsbanden zu isolieren.
Den Biophysikern PD Dr. Reiner Vogel und Dr. Ekaterina Zaitseva vom Institut für Molekulare Medizin und Zellforschung der Universität Freiburg ist es in einer engen Zusammenarbeit mit Shixin Ye und Thomas P. Sakmar in New York sowie Xavier Deupi in Barcelona gelungen, eine molekulare Sonde in ein Protein einzubauen und deren Veränderungen während der Arbeit des Proteins im Detail spektroskopisch zu verfolgen.
Während die Proteine unserer Zellen normalerweise aus einem eng begrenzten Repertoire von Bausteinen, den Aminosäuren, zusammengesetzt werden, wurden die Zellen hier veranlasst, einen eingeschleusten künstlichen Baustein gezielt einzubauen. Dieser künstliche Baustein, p-azido-Phenylalanin, wurde für die spektroskopischen Methoden maßgeschneidert und trägt eine so genannte Azido-Gruppe aus drei Stickstoffatomen, die in einem isolierten spektralen Bereich absorbiert und nicht von anderen Schwingungen überlagert ist.
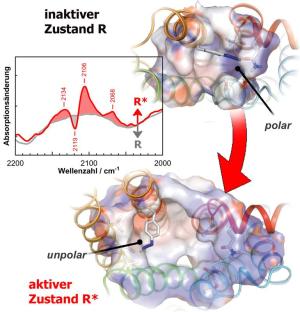
Diese Technik wurde auf den Lichtrezeptor Rhodopsin angewandt, ein Membran-Protein in den für das Sehen zuständigen Sinneszellen der Netzhaut.
Absorbiert das Rhodopsin ein Photon, so durchläuft es eine Reihe von Zwischenstufen, so genannte Intermediaten, in denen sich die durch die Lichtreaktion induzierten Veränderung innerhalb des Rezeptors sukzessive ausbreiten, bis er schließlich voll aktiviert ist und wiederum nachgeschaltete Elemente der Signalübertragungskette aktivieren kann.
Mithilfe der neu entwickelten Technik konnten die Freiburger Wissenschaftler und ihre Kollegen nun diese strukturellen Veränderungen innerhalb der einzelnen Intermediate genauer untersuchen.
In ihrem Beitrag in der Zeitschrift 'Nature' [siehe unten] zeigen sie unter anderem, dass Bewegungen von kompletten Strukturelementen schon erheblich früher nach der Lichtabsorption auftreten als bisher angenommen wurde. Die beteiligten Biophysiker sind zuversichtlich, dass die an Rhodopsin gewonnenen Erkenntnisse auch unser Verständnis der Aktivierung anderer Rezeptoren prägen werden. Durch ihre Sensitivität für elektrostatische Veränderung wird durch diese neue Technik das Methoden-Repertoire der Biophysik um eine wichtige Komponente erweitert.
Zusatzinformationen:
Shixin Ye, Ekaterina Zaitseva, Gianluigi Caltabiano, Gebhard F. X. Schertler, Thomas P. Sakmar, Xavier Deupi & Reiner Vogel:
Tracking G-protein-coupled receptor activation using genetically encoded infrared probes.
In: Nature; 464, 1386–1389, 29. April 2010, DOI 10.1038/nature08948
Quelle: Albert-Ludwigs-Universität Freiburg im Breisgau
Aktualisiert am 30.04.2010.
Permalink: https://www.internetchemie.info/news/2010/apr10/molekulare-sonde-fuer-proteine.php
© 1996 - 2026 Internetchemie ChemLin