Wissenschaftler um Prof. Dr. Frank Glorius und Prof. Dr. Stefan Grimme vom Organisch-Chemischen Institut der Westfälischen Wilhelms-Universität Münster haben einen neuartigen Katalyse-Mechanismus entwickelt, mit dem ihnen die metallfreie Aktivierung reaktionsträger Moleküle gelungen ist.
Metallfreie Katalyse-Mechanismen in chemischen Reaktionen gelten als erstrebenswert, um Verunreinigungen in den Reaktionsprodukten zu vermeiden und auf teure Metalle als Katalysatoren verzichten zu können.
Die Studie wurde nun in der international angesehenen Fachzeitschrift Angewandte Chemie veröffentlicht.
Dabei wurde sie als "besonders wichtig" (very important paper) eingestuft - eine Ehre, die weniger als 5 Prozent der Manuskripte zuteilwird.
Mit Katalyse bezeichnen Chemiker die Beschleunigung und Steuerung chemischer Reaktionen durch bestimmte Substanzen, sogenannte Katalysatoren. "Die Katalyse ermöglicht den schonenden Umgang mit Rohstoffen und Energie. Sie ist daher eine wichtige Zukunftstechnologie", betont Frank Glorius. Häufig werden hierbei metallhaltige Verbindungen verwendet, wie zum Beispiel bei Abgaskatalysatoren in Autos. Dort werden Platin und andere teure Schwer- beziehungsweise Edelmetalle eingesetzt. "Aus verschiedenen Gründen möchte man auf den Einsatz von Metallen verzichten: zum einen wegen der hohen Kosten und der Knappheit an Edelmetallen, aber auch zur Vermeidung giftiger Metallverunreinigungen in den Produkten." Zahlreiche Arbeitsgruppen weltweit beschäftigen sich daher intensiv mit der Entwicklung metallfreier Katalysatorsysteme, den sogenannten Organokatalysatoren, die aus organischer Materie - bestimmten Kohlenstoff-Verbindungen - bestehen und keine Metalle enthalten.
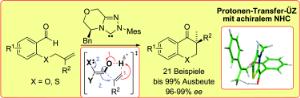
Bei der nun von dem münsterschen Forscherteam angewendeten dualen Katalyse aktiviert der Organokatalysator einen der Reaktionspartner an zwei Stellen. "Man könnte sagen, dass der Katalysator an einem Ende drückt und gleichzeitig am anderen Ende zieht", veranschaulicht Frank Glorius die Reaktion. Durch diese konzertierte Aktion gelingt die Aktivierung und damit schließlich die Umsetzung der Ausgangsverbindung in das gewünschte Produkt. "Dabei verläuft die Umsetzung außergewöhnlich selektiv. Von zwei möglichen spiegelbildlich aussehenden Produkten wird ausschließlich eines gebildet - man spricht hier von asymmetrischer Katalyse." Diese Reinheit - Chemiker nennen sie auch "Selektivität" - ist zum Beispiel besonders wichtig, wenn die Endprodukte als Medikamente angewendet werden sollen.
"Ein Verständnis der zugrunde liegenden Reaktionsmechanismen auf atomarer Ebene ist sehr wichtig für weitere Entwicklungen", betont Stefan Grimme. Seine Gruppe hat daher den Mechanismus mit modernsten quantenchemischen Methoden am Computer untersucht. "Damit können wir den Atomen sozusagen bei ihren Bewegungen zusehen. Dieser Art von virtueller Chemie kommt heute in der Forschung immer größere Bedeutung zu."
Duale Katalyse ist eines der Themen, die in dem neuen münsterschen Sonderforschungsbereich 858 "Synergetische Effekte in der Chemie - Von der Additivität zur Kooperativität" von der Deutschen Forschungsgemeinschaft gefördert werden.
Zusatzinformationen:
Isabel Piel, Marc Steinmetz, Dr. Keiichi Hirano, Dr. Roland Fröhlich, Prof. Dr. Stefan Grimme, Prof. Dr. Frank Glorius:
Hoch asymmetrische NHC-katalysierte Hydroacylierung nichtaktivierter Alkene.
In: Angewandte Chemie; online veröffentlicht am 14. April 2011, DOI 10.1002/ange.201008081
Quelle: Westfaelische Wilhelms-Universität, Münster
Aktualisiert am 15.04.2011.
Permalink: https://www.internetchemie.info/news/2011/apr11/nhc-katalysierte-hydroacylierung.php
© 1996 - 2026 Internetchemie ChemLin