Damit Enzyme und andere Eiweiße unseres Organismus richtig arbeiten können, müssen sich oft mehrere Protein-Einheiten zu einem größeren Ganzen zusammenlagern. Ketten aus Zuckermolekülen können so etwas nicht - dachte man zumindest bisher.
Ein Team um Thomas Heinze von der Universität Jena und Stephen E. Harding von der University of Nottingham (Großbritannien) hat nun das Gegenteil bewiesen.
In der Zeitschrift Angewandte Chemie stellen die Forscher ihre Entdeckung vor: Cellulose-ähnliche Kohlenhydrate, die definierte Aggregate aus mehreren Untereinheiten bilden können.
Die einzelnen Proteinuntereinheiten funktionaler Eiweiße sind nicht chemisch miteinander verbunden, sondern werden durch physikalische Anziehungskräfte beieinander gehalten und können sich je nach Umgebungsbedingungen auch wieder trennen. Bisher war man davon ausgegangen, dass Moleküle aus vielen Zuckereinheiten, die so genannten Polysaccharide, dieses Verhalten nicht zeigen. Definierte, reversible Aggregate aus mehreren solchen Zuckerketten wurden bisher nicht beobachtet. Das deutsch-britische Forscherteam konnte nun erstmals eine proteinähnliche Zusammenlagerung von Kohlenhydraten zu definierten Oligomeren nachweisen - ein neuartiges und ganz unerwartetes Phänomen.
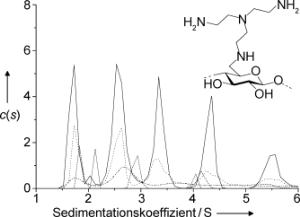
Als Studienobjekt dienten den Wissenschaftlern stickstoffhaltige Cellulose-ähnliche Polysaccharide. Cellulose, Hauptbestandteil pflanzlicher Zellwände, ist neben Stärke der bekannteste Vertreter der Polysaccharide. Die Forscher untersuchten so genannte Aminocellulosen mithilfe der analytischen Ultrazentrifugation. Ultrazentrifugen rotieren bis zu 500.000 mal pro Minute. Durch die entsprechend hohe Zentrifugalkraft werden große Moleküle zum Sedimentieren gebracht. Anhand der Sedimentationsgeschwindigkeit lässt sich die ungefähre Molmasse der Makromoleküle ermitteln. Die Forscher fanden auf diese Weise, je nach Versuchsbedingungen, bis zu fünf verschiedene Spezies in ihren Aminocellulose-Lösungen. Deren Molmassen erwiesen sich als Vielfache der Masse des Monomers, also offenbar Aggregate aus zwei bis fünf Polysaccharid-Bausteinen. Wie sich zeigte, dissoziieren die Aggregate wieder, wenn die Lösung verdünnt wird. Die Bindung ist also reversibel.
Die Forscher vermuten, dass Aminocellulosen nicht nur untereinander wechselwirken, sondern in ähnlicher Weise auch mit bestimmten anderen Biomolekülen. Sie könnten daher interessant sein als Grenzflächenmaterialien mit biologischer Erkennungsfunktion, über die etwa Proteine immobilisiert werden könnten. Damit können beispielsweise Schnellanalysen außerhalb von Laboren realisiert werden, mit denen sich binnen Minuten Giftstoffe und Krankheitserreger nachweisen lassen. Einsatzgebiete sind die Detektion von Tierseuchenerregern und Lebensmittelkontaminationen sowie der Nachweis von biologischen Kampfstoffen wie Anthrax, des Ebola-Virus und des Botulinus-Toxins im dezentralen Einsatz.
Zusatzinformationen:
Prof. Dr. Thomas Heinze, Dipl.-Chem. Melanie Nikolajski, Dr. Stephan Daus, MSc. Tabot M. D. Besong, Dipl.-Chem. Nico Michaelis, Dr. Peter Berlin, Dr. Gordon A. Morris, Prof. Dr. Arthur J. Rowe, Prof. Dr. Stephen E. Harding:
Proteinähnliche Oligomerisierung von Kohlenhydraten.
In: Angewandte Chemie; online veröffentlicht am 22. Juli 2011, DOI 10.1002/ange.201103026
Quelle: Angewandte Chemie, Presseinformation Nr. 30/2011
Aktualisiert am 27.07.2011.
Permalink: https://www.internetchemie.info/news/2011/jul11/kohlenhydrat-oligomerisierung.php
© 1996 - 2026 Internetchemie ChemLin