Molekulare Motoren sind die Basis für die meisten biologischen Bewegungen. Sie setzen Zellbestandteile, ganze Zellen oder auch unsere Muskeln zielgerichtet in Bewegung.
Barbara Imperiali und ein Team vom Massachusetts Institute of Technology (Cambridge, USA), der University of Virginia (Charlottesville, USA) und den National Institutes of Health (USA) haben das Motorprotein Myosin nun mit einem "Anschaltknopf" versehen, der durch Licht ausgelöst wird.
Wie die Wissenschaftler in der Zeitschrift Angewandte Chemie berichten [siehe unten], sollen damit zelluläre Prozesse, an denen Myosin beteiligt ist, in Echtzeit verfolgt werden.
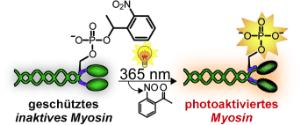
Damit sich unsere Muskeln zusammenziehen, müssen zwei Sorten fadenförmiger Proteine, Myosin und Actin, wechselwirken. Angetrieben durch Spaltung des zellulären "Treibstoffs" Adenosintriphosphat (ATP) "hangeln" sich die "Köpfchen" der Myosinmoleküle dabei an den Actinfilamenten entlang. In Nicht-Muskelzellen sorgt Myosin beispielsweise bei der Zellteilung dafür, dass sich die Zelle einschnürt. Myosin besteht aus mehreren verschiedenen Proteinketten. Die Aktivität des nicht-muskulären Myosins wird durch dessen so genannte regulatorische leichte Kette reguliert. Sobald eine Phosphatgruppe an eine bestimmte Bindungsstelle (Ser19) der leichten Kette bindet (Phosphorylierung), wird Myosin aktiviert. Die Aktivität lässt sich durch Bindung einer zweiten Phosphatgruppe an benachbarter Stelle (Thr18) weiter verstärken.
Myosin wurde bereits intensiv untersucht. Was genau nach Aktivierung des Moleküls in lebenden Zellen passiert, konnte bisher jedoch nicht räumlich und zeitlich aufgelöst untersucht werden. Das Forscherteam hat nun einen Kniff gefunden, wie sich solche Echtzeituntersuchungen realisieren lassen: Ein Myosinmolekül, das sich mit Licht definiert "anknipsen" lässt. Dazu stellten die Forscher per Proteinsemisynthese eine künstliche regulatorische Kette her, die bereits eine bzw. zwei Phosphatgruppen trägt. Der Trick: Über die Phosphatgruppen wird ein "Käfig" gestülpt. In dieser Form ist die Kette inaktiv. Bestrahlung mit Licht spaltet den Käfig ab, die regulatorische Kette ist nun auf "an" geschaltet und aktiviert ihrerseits das Myosin.
Die Forscher tauschten die natürliche leichte Kette von Myosinmolekülen gegen die künstliche aus und schleusten dieses photoaktivierbare Myosin in Zellen ein. Bestrahlung aktiviert es dann zu einem definierten Zeitpunkt und an definierter Stelle. Auf diese Weise wollen die Wissenschaftler nun in Echtzeit beobachten, was nach einer Aktivierung von Myosin in einer Zelle passiert.
Zusatzinformationen:
Brenda N. Goguen, Dr. Brenton D. Hoffman, Dr. James R. Sellers, Prof. Martin A. Schwartz, Prof. Barbara Imperiali:
Light-Triggered Myosin Activation for Probing Dynamic Cellular Processes.
In: Angewandte Chemie; online veröffentlicht am 03. Mai 2011, DOI 10.1002/ange.201100674
Quelle: Angewandte Chemie, Presseinformation Nr. 18/2011
Aktualisiert am 11.05.2011.
Permalink: https://www.internetchemie.info/news/2011/may11/photoaktivierbares-myosin.php
© 1996 - 2026 Internetchemie ChemLin