Ultraviolette (UV) Anteile im Sonnenlicht können zu Schädigungen der Haut bis hin zum Hautkrebs führen. Grund dafür sind gefährliche DNA-Mutationen, die zur Folge haben, dass die Erbinformation nicht mehr oder nicht mehr korrekt abgelesen werden kann.
Eine mögliche Mutation ist der sogenannte Dewar-Schaden, der selbst wieder erbgutverändernde Schäden auslöst - eine Aufklärung der Mechanismen, die zur Dewar-Bildung führen ist also von großem Interesse.
LMU-Wissenschaftler konnten nun nachweisen, dass das DNA-Rückgrat dabei eine entscheidende Rolle spielt: Erst ein intaktes Rückgrat macht die Mutation möglich - ist das Rückgrat offen und damit flexibel, kann die Reaktion nicht ablaufen. Damit zeigt sich eine überraschende Doppelrolle des Rückgrats: Einerseits ist es die Grundvoraussetzung für die Funktion der DNA und somit von fundamentaler Bedeutung für alle lebenden Organismen. Andererseits ist es die Ursache für den Dewar-Schaden und trägt dadurch zur UV- induzierten Mutagenese bei.
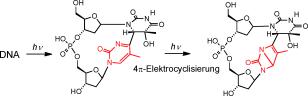
UV-induzierte DNA-Schäden entstehen durch molekulare Veränderungen, die zu Strukturänderungen führen und Mutationen oder sogar den Zelltod einleiten können. Zunächst erzeugt die energiereiche UV-Strahlung hauptsächlich zwei Arten von Mutationen: sogenannte CPD-Schäden und (6-4)-Photoschäden. Beide entstehen, indem benachbarte DNA-Bausteine eine Verbindung eingehen. Aus dem (6-4)-Schaden kann bei fortgesetzter Aufnahme von UV-Strahlung eine weitere Strukturänderung erfolgen. Auf diese Weise entsteht ein sogenannter Dewar-Schaden, der bei kontinuierlicher Sonnenbestrahlung ein stabiles Endprodukt darstellt - und hochmutagen ist, also selbst wieder erbgutverändernde Schäden auslöst. "Während die Entstehung der CPD- und (6-4)- Schäden bereits gut untersucht ist, traf dies für die Dewar-Schäden bisher nicht zu", sagt der LMU-Chemiker Professor Thomas Carell, der auch dem Exzellenzcluster "Center for Integrated Protein Science Munich" (CIPSM) angehört.
In einem gemeinsamen Projekt im Rahmen des SFB749 konnte Carells Gruppe nun zusammen mit Teams um den LMU-Physiker Professor Wolfgang Zinth (CIPSM) und Regina de Vivie-Riedle vom Department Chemie zeigen, dass das DNA-Rückgrat eine entscheidende Rolle spielt. Das Rückgrat besteht aus sich regelmäßig abwechselnden Zucker- und Phosphat-Molekülen, die den Protein-codierenden DNA-Bausteinen Halt geben. "Zu unserer Überraschung stellte sich heraus, dass der Dewar-Schaden nur dann eintritt, wenn ein intaktes Rückgrat den betroffenen DNA-Bereich stützt", erklärt Carell, "weder die chemisch identische Substanz mit offenem Rückgrat, noch die freien Basenpaare zeigen die Dewar-Bildung bei Bestrahlung mit Sonnenlicht." Die interdisziplinäre Zusammenarbeit der drei Arbeitsgruppen aus den Bereichen Chemie, Physik und Theorie ermöglichte es, die photochemische Dewar-Bildung erstmals auf atomarer Ebene direkt zu verfolgen. "Dabei zeigten unsere Ergebnisse, dass die Dewar-Bildung bemerkenswert effektiv ist und zu einer der effizientesten lichtinduzierten Reaktionen der DNA gehört", erläutert der Physiker Zinth.
Einblicke in die mechanistischen Details der photochemischen Dewar-Bildung kamen aus der Theorie. "Um die Photochemie auf hohem Niveau verfolgen zu können, haben wir eine neue Hybridmethode konzipiert, mit der wir die Dynamik in zusammengesetzten Molekülbereichen auf unterschiedlich hohem quantenmechanischem Niveau verfolgen können", sagt de Vivie-Riedle. Basierend auf ihren Berechnungen konnten die Wissenschaftler eindeutig klären, welche Rolle das DNA-Rückgrat für die Dewar-Bildung spielt: Ein offenes Rückgrat macht die Moleküle flexibel - dieser Zustand erlaubt nach einem (6-4)-Schaden nur den photophysikalischen Rückweg zum Ausgangsprodukt. Ein intaktes Rückgrat dagegen macht das Molekül starr: Die Ringspannung unterdrückt die Flexibilität, nur die Atome der neu zu bildenden Dewar-Bindung bleiben beweglich. Damit ist der Weg zum Dewar-Schaden frei.
Die Arbeiten wurden von der DFG im Rahmen des Sonderforschungsbereichs (SFB) 749 "Dynamik und Intermediate molekularer Transformationen" und des Exzellenzclusters "Center for Integrated Protein Science Munich" (CIPSM) gefördert. Regina de Vivie-Riedle und Wolfgang Zinth sind auch Mitglied des Exzellenzclusters "Munich Centre of Advanced Photonics" (MAP). (göd)
Zusatzinformationen:
Karin Haiser, Dr. Benjamin P. Fingerhut, Korbinian Heil, Dr. Andreas Glas, Teja T. Herzog, Bert M. Pilles, Dr. Wolfgang J. Schreier, Prof. Dr. Wolfgang Zinth, Prof. Dr. Regina de Vivie-Riedle, Prof. Dr. Thomas Carell:
Mechanismus der UV-induzierten Bildung von Dewar-Schäden in DNA.
In: Angewandte Chemie; online veröffentlicht am 23. November 2011, DOI 10.1002/ange.201106231
Quelle: Ludwig-Maximilians-Universität München, LMU
Aktualisiert am 28.11.2011.
Permalink: https://www.internetchemie.info/news/2011/nov11/dewar-schaden-mechanismus.php
© 1996 - 2026 Internetchemie ChemLin