Sowohl beim Menschen als auch bei einfachen Bakterien ist Gluconeogenese, die Fähigkeit, Zucker aus einfacheren chemischen Bausteinen neu zu synthetisieren, ein zentraler Weg des Stoffwechsels.
Dieser Prozess konnte jedoch bisher wissenschaftlich nicht abschließend analysiert werden.
Die Arbeitsgruppen von Prof. Dr. Oliver Einsle vom Institut für Organische Chemie und Biochemie, Zentrum für Biologische Signalstudien (BIOSS), Freiburg Institute of Advanced Studies (FRIAS) sowie von der Spemann Graduiertenschule (SGBM) und Prof. Dr. Georg Fuchs vom Institut für Biologie II haben nun einen grundlegend neuartigen Typ multifunktioneller Enzyme in diesem Stoffwechselweg beschrieben.
In einer Ausgabe des Fachmagazins Nature stellten sie ihre Ergebnisse vor [siehe unten].
Die Aldolase, ein zentrales Enzym der Gluconeogenese, schien bei dem gesamten Organismenreich der Archaea, so genannter Urbakterien, zu fehlen. Dr. Rafael Say und Georg Fuchs entdeckten im Jahr 2010, dass das Enzym Fructose-1,6-bisphosphatase auch die Aufgabe der Aldolase übernehmen konnte, obwohl die Aminosäuren des Enzyms, die an der Aldolasereaktion beteiligt sind, weit von der Bindestelle des Substrats entfernt waren.
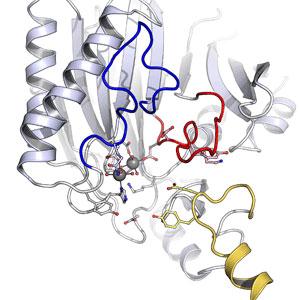
Um dieses scheinbare Paradoxon aufzulösen, wurde das Enzym Fructose-1,6-bisphosphat-Aldolase/Phosphatase (FBPAP) von Juan Du und Dr. Wei Lü in der Arbeitsgruppe von Oliver Einsle untersucht. Dabei konnten dreidimensionale Raumstrukturen bei hoher Auflösung bestimmt werden, die einen überraschend komplexen Reaktionsmechanismus im Detail aufzeigten. Das Ergebnis: Es ist das Protein selbst, das sich um das fest gebundene Substratmolekül herum neu organisiert. Gelenkt wird dieser komplizierte Prozess durch die Bindung zusätzlicher Magnesiumionen, die in der Zelle in hinreichender Menge zur Verfügung stehen. Durch diese Bindung verändern sich drei Bereiche des Enzyms grundlegend, und das Aktivzentrum verwandelt sich von einer Aldolase in eine Phosphatase.
Die Freiburger Forscher haben mit diesem Mechanismus ein neuartiges multifunktionelles Enzym charakterisiert. Es ist anzunehmen, dass derartige zusätzliche katalytische Fähigkeiten auch bei anderen Proteinen vorkommen, dort aber bislang unentdeckt blieben. Im Fall der FBPAP stellt dieser ungewöhnliche Mechanismus vermutlich eine Anpassung an das Leben bei hohen Temperaturen dar, bei denen die Ausgangsstoffe der Reaktion nicht stabil sind.
Zusatzinformationen:
Juan Du, Rafael F. Say, Wei Lü, Georg Fuchs und Oliver Einsle:
Active-site remodelling in the bifunctional fructose-1,6-bisphosphate aldolase/phosphatase.
In: Nature; online veröffentlicht am 09. Oktober 2011, DOI 10.1038/nature10458
Quelle: Albert-Ludwigs-Universität Freiburg im Breisgau
Aktualisiert am 10.10.2011.
Permalink: https://www.internetchemie.info/news/2011/oct11/gluconeogenese-multifunktionelle-enzyme.php
© 1996 - 2026 Internetchemie ChemLin