
Wissenschaftler der Universitäten Bonn und Jena, der TU Darmstadt sowie des Leibniz-Instituts für Altersforschung in Jena haben nun die Struktur und Wirkung verschiedener Formen des Kegelschneckentoxins μ-PIIIA aufgeklärt.
Sie stellten ihre Ergebnisse in der Zeitschrift "Angewandte Chemie" vor [siehe unten].
Gut versteckt im Schlamm wartet die Kegelschnecke Conus purpurascens auf ihre Opfer. Die wurmartig bewegte Atemröhre der Schnecke ragt aus dem Schlamm hervor und lockt Fische an - die Beute der Schnecke. Kommt ein Fisch neugierig näher, schießt die Schnecke blitzschnell eine giftige Harpune auf ihn ab, die sich aus einem Zahn ihrer Raspelzunge entwickelt hat. Das gelähmte Opfer lässt sich anschließend leicht von der Schnecke verspeisen. Rund zwei Wochen braucht die giftige Kegelschnecke, um den Fisch zu verdauen. In dieser Zeit regeneriert sich auch wieder ihre Gift-Harpune.
"Wir interessieren uns für die Nervengifte der Kegelschnecke, die Conotoxine heißen", sagt Prof. Dr. Diana Imhof vom Pharmazeutischen Institut der Universität Bonn, die das Projekt federführend leitet. Sie wirken in kleinsten Mengen, unterbrechen sehr selektiv die Signalübertragung in den Nervenbahnen und können damit die Schmerzweiterleitung gut blockieren. Damit sind diese Toxine sehr interessant für die Entwicklung von Schmerzmitteln für terminal Krebskranke oder Patienten mit chronischen Schmerzen, bei denen keine anderen Therapeutika mehr eingesetzt werden können. "Der Vorteil solcher Conotoxine ist, dass sie nicht abhängig machen", berichtet die pharmazeutische Chemikerin. "Da das von uns untersuchte Peptid im Körper recht schnell abgebaut wird, braucht man aber stabilere Formen zur Verabreichung."
Die Wissenschaftler vervielfältigten das rare Gift im Labor
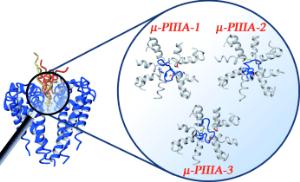
Die Bonner Forscher arbeiteten mit Prof. Dr. Stefan H. Heinemann vom Lehrstuhl für Biophysik der Universität Jena, Wissenschaftlern des Leibniz-Instituts für Altersforschung Jena und der TU Darmstadt zusammen. "Das für die Wirkstoffuntersuchung interessierende Gift Conotoxin µ-PIIIA kommt nur in außerordentlich geringen Mengen in den marinen Kegelschnecken vor", sagt Erstautorin Dr. Alesia A. Tietze, die im Team von Prof. Imhof promoviert hat. Den Wissenschaftlern gelang es jedoch, das spezielle Gift in größerem Umfang auf chemischem Wege im Labor für weitere Untersuchungen herzustellen. "So konnten wir die Struktur verschiedener Varianten des Conotoxins µ-PIIIA mit Hilfe der Kernresonanzspektroskopie aufklären und deren unterschiedliche Wirkung untersuchen", sagt die Wissenschaftlerin.
Bei dem besagten Gift handelt es sich um eine Substanz, bei dem verschiedene Aminosäuren wie bei einer Perlenkette aufgereiht sind. "Diese Kette kann sich auf verschiedene Weise verknäueln und so unterschiedliche dreidimensionale Strukturen ausbilden", erläutert Prof. Imhof. Bisher glaubte man, dass nur eine einzige dieser Formen eine biologische Wirkung entfaltet. "Genau dieses Dogma konnten wir aber widerlegen", berichtet die Bonner Wissenschaftlerin. "Wir haben drei aktive Faltungen des Peptids mit ähnlicher Wirkung identifiziert - wahrscheinlich gibt es sogar noch mehr." Diese Varianten unterscheiden sich jedoch leicht hinsichtlich ihrer biologischen Wirkung und sind daher wertvolle Startstrukturen für eine Weiterentwicklung hin zu Schmerzmitteln.
Daher wollen die Wissenschaftler weitere Untersuchungen durchführen, um noch mehr über diese unterschiedlichen Faltungsvarianten des Conotoxins μ-PIIIA herauszufinden. Es wird jedoch noch Jahre dauern, bis möglicherweise Patienten davon profitieren. "Unsere Untersuchungen befinden sich noch im Stadium der Grundlagenforschung", sagt Prof. Imhof.
Zusatzinformationen:
Alesia A. Tietze, Dr. Daniel Tietze, Dr. Oliver Ohlenschläger, Dr. Enrico Leipold, Florian Ullrich, Toni Kühl, André Mischo, Prof. Dr. Gerd Buntkowsky, Dr. Matthias Görlach, Prof. Dr. Stefan H. Heinemann, Prof. Dr. Diana Imhof:
Strukturell diverse Isomere des μ-Conotoxins PIIIA blockieren den Natriumkanal NaV1.4.
In: Angewandte Chemie; online veröffentlicht am 12. März 2012, DOI 10.1002/ange.201107011
Quelle: Rheinische Friedrich-Wilhelms-Universität, Bonn
Aktualisiert am 03.04.2012.
Permalink: https://www.internetchemie.info/news/2012/apr12/schmerzstillende-conotoxine.php
© 1996 - 2026 Internetchemie ChemLin