Forscherinnen und Forscher von der Universität Freiburg sowie dem russischen Forschungsinstitut Gamaleya in Moskau haben aufgedeckt, dass Legionellen durch Giftstoffe die Herstellung der Eiweiße in Wirtszellen stören.
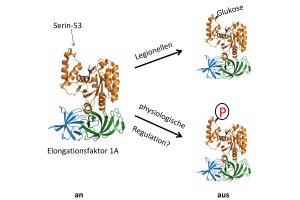
Hierbei wird der Zucker Glukose an den so genannten Elongationsfaktor 1A geheftet, der als Hilfsfaktor eine Schlüsselrolle bei der Herstellung von Eiweißen hat.
Dadurch gelingt es den Legionellen, für sich selbst einen optimalen Lebensraum zu schaffen.
Gleichzeitig vergiften sie die Wirtszelle, wie die Wissenschaftler in der renommierten Fachzeitschrift Journal of Biological Chemistry berichten [siehe unten].
Beim Menschen kann dies zu einer gefährlichen Lungenentzündung führen.
Schon in früheren Arbeiten konnten die Freiburger Arbeitsgruppe um Prof. Dr. Dr. Klaus Aktories sowie seine Kooperationspartner in Moskau eine Gruppe von Giftstoffen identifizieren, durch die Legionellen Glukose auf den Elongationsfaktor 1A übertragen. Aktories ist Direktor des Instituts für Experimentelle und Klinische Pharmakologie und Toxikologie sowie Mitglied des Centre for Biological Signalling Studies (BIOSS).
Die Untersuchungen basieren auf Hefezellen, die als beispielhafte Wirtszellen eingesetzt wurden. Die Giftstoffe heften das Zuckermolekül selektiv an einen Baustein des Elongationsfaktors 1A in der Hefezelle. Wurde dieser Baustein, die Aminosäure Serin-53, durch eine ähnliche Aminosäure ersetzt, so kam es nicht mehr zu einer Vergiftung.
Interessanterweise führte auch der Austausch des Serin-53 durch die Aminosäure Glutamat zum Zelltod, wie die Forscher in ihren Experimenten bestätigt haben. "Serin-53 könnte eine Schalterfunktion für die Eiweißsynthese in der Zelle haben. Wir vermuten, dass Zellen diesen Schalter normalerweise über eine Phosphorylierung von Serin-53 aktivieren, also über die Anheftung von Phosphorsäure. Glutamat täuscht eine Phosphorylierung vor und schaltet auf diesem Wege die Eiweißsynthese aus.
Die Legionellen nutzen den Schalter hingegen über die Anheftung von Glukose an Serin-53, was die gleiche Wirkung hat, und stoppen so die Einweißsynthese", sagt Aktories.
Damit konnten durch die Toxin-Untersuchungen in Hefe neue regulatorische Bausteine im Elongationsfaktor 1A gefunden werden, die offenbar für die Eiweißsynthese essentiell sind.
Zusatzinformationen:
Yury Belyi, Dina Tartakovskaya, Arlette Tais, Edith Fitzke, Tina Tzivelekidis, Thomas Jank, Sabine Rospert und Klaus Aktories:
Elongation Factor 1A Is the Target of Growth Inhibition in Yeast Caused by Legionella pneumophila.
In: The Journal of Biological Chemistry; online veröffentlicht am 27. Juli 2012, DOI 10.1074/jbc.M112.372672
Quelle: Albert-Ludwigs-Universität, Freiburg im Breisgau
Aktualisiert am 06.08.2012.
Permalink: https://www.internetchemie.info/news/2012/aug12/legionellen-giftstoffe.php
© 1996 - 2026 Internetchemie ChemLin