Ob Margarine, Kunstdünger oder Plastikbecher: Bei der Herstellung vieler Produkte spielt das chemische Prinzip der Katalyse eine wichtige Rolle.
Im Produktionsprozess sorgt dann ein so genannter Katalysator dafür, dass bestimmte Reaktionen überhaupt erst ablaufen.
Nur mit Katalysatoren lässt sich Pflanzenöl zu Margarine härten, nur mit ihnen lassen sich Polyethylen und andere Kunststoffe fabrizieren.
Beispiel Margarine: Um aus flüssigem Pflanzenöl ein streichfähiges Fett zu machen, müssen Bindungen in Wasserstoff-Molekülen gebrochen werden.
Dafür sorgt ein metallhaltiger Katalysator. Sein Metallatom schiebt Elektronen in die Bindungen, destabilisiert sie damit und macht sie bereit für die gewünschte Reaktion.
Etabliertes Modell auf den Kopf gestellt
Ein Metall gibt Elektronen und schwächt damit Bindungen: Chemiker kennen diesen Ablauf seit 1953 als "Dewar-Chatt-Duncanson-Modell". Nun aber muss das Modell erweitert werden - denn Chemiker der Universität Würzburg haben es auf den Kopf gestellt.
Die neue Erkenntnis: Die Elektronen eines Metalls können eine Bindung auch stärken - zumindest wenn es sich um eine Doppelbindung zwischen zwei Bor-Atomen handelt. Das berichten Forscher aus dem Arbeitskreis von Professor Holger Braunschweig jetzt in 'Nature Chemistry' [siehe unten].
Theorie mit Experiment bestätigt
In einer Doppelbindung zwischen zwei Bor-Atomen ist noch Platz für genau zwei zusätzliche Elektronen. Ein "freies p-Orbital", wie die Chemiker sagen. Wenn man diesen Platz füllt, müsste die Bindung stärker werden: Von dieser Überlegung gingen die Würzburger Chemiker Dr. Rian Dewhurst und Dr. Alfredo Vargas aus. Sie modellierten ihre Idee am Computer und fanden sie bestätigt - zunächst rein theoretisch.
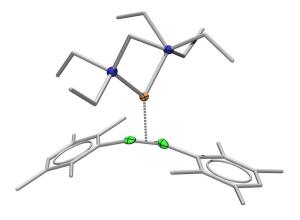
Nun galt es, die Theorie mit einem Experiment zu bestätigen. Im Arbeitskreis fand sich ein Molekül, das für diesen Zweck wie geschaffen war: ein so genannter Platin-Diboranyl-Komplex. Alexander Damme hatte ihn bei seiner Doktorarbeit in einem kniffligen Prozess synthetisiert.
Bor-Bor-Doppelbindung plus Platin
Kernstück des Komplexes sind zwei Bor-Atome, die durch eine einfache Bindung aneinander geknüpft sind und sich sehr nah bei einem Platin-Atom befinden. Damme tüftelte nun folgendes Verfahren aus: Er zwang dem Komplex zusätzliche Elektronen auf, so dass eine Bor-Bor-Doppelbindung entstand.
Durch den Einfluss des Metalls Platin hätte diese Doppelbindung - dem etablierten Modell zufolge - nun eigentlich schwächer ausfallen müssen als eine "normale" Bor-Bor-Doppelbindung. Tatsächlich aber war die Bindung stärker. Das zeigte sich bei der Einkristall-Röntgenstrukturanalyse des Materials. Mit dieser Technik lässt sich feststellen, wie weit die Atome eines Moleküls voneinander entfernt sind. Je näher sie sich stehen, umso stärker ist die Bindung zwischen ihnen. Und zwei Bor-Atome in einer Doppelbindung stehen sich in der Gegenwart von Platin deutlich näher als ohne das Metall, so das Ergebnis der Würzburger Chemiker.
Neues Wissen für die Lehrbücher
Welche Konsequenzen diese Entdeckung hat? Für die Alltagspraxis in den chemischen Labors und der Industrie vorerst keine. Aber die Lehrbücher der Chemie müssen ergänzt werden. Das "Dewar-Chatt-Duncanson-Modell" hat zwar nicht ausgedient; für Kohlenstoff-Verbindungen gilt es weiterhin. Aber es muss nun doch grundlegend erweitert werden. Wer weiß - vielleicht sogar um ein Modell, das den Namen "Braunschweig-Damme-Dewhurst-Vargas" trägt.
Zusatzinformationen:
Holger Braunschweig, Alexander Damme, Rian D. Dewhurst und Alfredo Vargas:
Bond-strengthening p backdonation in a transition-metal p-diborene complex.
In: Nature Chemistry; online veröffentlicht am 09. Dezember 2012, DOI 10.1038/NCHEM.1520
Quelle: Julius-Maximilians-Universität, Würzburg
Aktualisiert am 11.12.2012.
Permalink: https://www.internetchemie.info/news/2012/dec12/platin-diborenyl.php
© 1996 - 2026 Internetchemie ChemLin