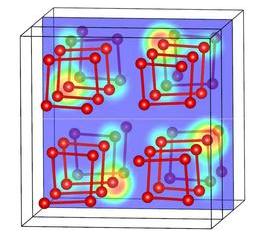
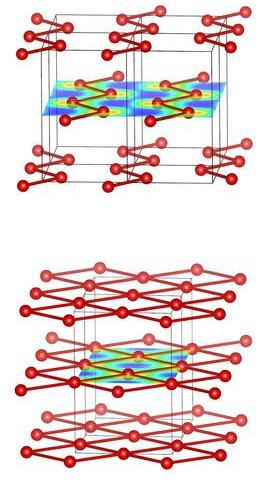
Mit Computersimulationen hat ein Forscher der RUB gezeigt, dass das Sauerstoff-Molekül (O2) Drücken bis zu 1,9 Terapascal standhält. Das entspricht dem 19-millionenfachen Atmosphärendruck.
Bei höheren Drücken polymerisiert Sauerstoff, bildet also größere Moleküle oder Strukturen.
"Das war sehr überraschend", sagt Dr. Jian Sun vom Lehrstuhl für Theoretische Chemie. "Andere einfache Moleküle wie Stickstoff oder Wasserstoff überleben solche hohen Drücke nicht."
In Kooperation mit Kollegen des University College London, der University of Cambridge und des National Research Council, Kanada berichtet der Wissenschaftler, dass sich Sauerstoff mit steigendem Druck sehr kompliziert verhält. Seine elektrische Leitfähigkeit steigt zunächst, sinkt dann und steigt schließlich wieder an.
Die Ergebnisse veröffentlichten die Forscher in der Zeitschrift Physical Review Letters [siehe unten].
Schwächere Bindung, aber höhere Stabilität
Eine Elektronenpaar-Doppelbindung hält die beiden Sauerstoffatome im O2-Molekül zusammen. Stickstoff (N2) hingegen besitzt eine Dreifachbindung. "Man würde denken, dass die schwächere Doppelbindung leichter aufzubrechen ist und dass Sauerstoff daher bei niedrigerem Druck polymerisiert als Stickstoff", so Sun. "Wir haben aber das Gegenteil gefunden. Das war auf den ersten Blick erstaunlich."
Näher zusammenrücken, wenn der Druck steigt
Im kondensierten Zustand, wenn der Druck steigt, kommen die Moleküle näher zusammen. Das Forscherteam nimmt an, dass sich unter diesen Bedingungen die freien Elektronenpaare der verschiedenen Moleküle gegenseitig abstoßen. Das hindert sie daran, sich einander anzunähern. Da Sauerstoff mehr freie Elektronenpaare als Stickstoff besitzt, ist die Abstoßungskraft zwischen den Sauerstoff-Molekülen stärker, was das Polymerisieren erschwert. Allerdings kann die Anzahl der freien Elektronenpaare nicht das einzige sein, was den Druck bestimmt, bei dem die Polymerisation eintritt. "Wir denken, es ist eine Kombination aus der Anzahl der freien Elektronenpaare und der Stärke der Bindung zwischen den einzelnen Molekülen", erklärt Sun.
Die vielen Strukturen des Sauerstoffs
Bei hohen Drücken polymerisieren gasförmige Moleküle wie Wasserstoff, Kohlenmonoxid oder Stickstoff und werden so zu Ketten, Schichten oder Netzwerkstrukturen. Gleichzeitig wandeln sie sich üblicherweise von Isolatoren in Metalle um, d.h. mit steigendem Druck werden sie leitfähiger. Das Forscherteam zeigte jedoch, dass die Lage mit Sauerstoff etwas komplizierter ist. Unter Standardbedingungen hat das Molekül isolierende Eigenschaften. Steigt der Druck, metallisiert es und wird zum Supraleiter. Bei weiterem Druckanstieg wird Sauerstoff zunächst zum Halbleiter mit Polymerstruktur. Dann nimmt er erneut metallische Eigenschaften an, seine Leitfähigkeit steigt also wieder. Das metallische Polymer verwandelt sich schließlich in eine metallische Struktur aus vielen Schichten.
Im Inneren von Planeten
"Die Polymerisation kleiner Moleküle unter hohem Druck hat viel Aufmerksamkeit auf sich gezogen. Sie hilft, die fundamentale Physik und Chemie geologischer und planetarischer Prozesse zu verstehen", erklärt Sun. "Der Druck im Inneren von Jupiter wird zum Beispiel auf etwa sieben Terapascal geschätzt. Man hat auch herausgefunden, dass polymerisierte Moleküle, wie N2 und CO2, verblüffende Eigenschaften haben. Sie haben etwa eine hohe Energiedichte oder sind superhart." Dr. Jian Sun trat 2008 als Humboldt-Stipendiat der RUB-Arbeitsgruppe von Prof. Dr. Dominik Marx bei, um mit der Vibrationsspektroskopie wässrige Lösungen zu untersuchen. Parallel zu dieser Arbeit in der Lösungsmittelchemie ("Solvation Science") verfolgt er als Nachwuchsforscher physikalisch-chemische Prozesse im Hochdruck-Bereich.
Zusatzinformationen:
Jian Sun, Miguel Martinez-Canales, Dennis D. Klug, Chris J. Pickard und Richard J. Needs:
Persistence and Eventual Demise of Oxygen Molecules at Terapascal Pressures.
In: Physical Review Letters; Volume 108, Issue 4, 27. Januar 2012, DOI 10.1103/PhysRevLett.108.045503
Quelle: Ruhr-Universität Bochum, RUB
Aktualisiert am 30.01.2012.
Permalink: https://www.internetchemie.info/news/2012/jan12/hochdruck-sauerstoff-strukturen.php
© 1996 - 2026 Internetchemie ChemLin