Von Methanol zu Formaldehyd - diese Reaktion ist der Ausgangspunkt für die Synthese vieler alltagsrelevanter Kunststoffe.
Mit Katalysatoren aus Goldpartikeln könnte sich Formaldehyd herstellen lassen, ohne dass umweltschädliche Abfälle wie bei herkömmlichen Verfahren entstehen.
Wie der mysteriöse Goldkatalysator funktioniert, haben theoretisch und experimentell arbeitende Forscher der Ruhr-Universität Bochum in einem Kooperationsprojekt herausgefunden.
In der 'International Edition' der Zeitschrift 'Angewandte Chemie' berichten sie im Detail, was bei der chemischen Reaktion an der Goldoberfläche passiert.
Eigentlich sollte Gold als Katalysator ungeeignet sein
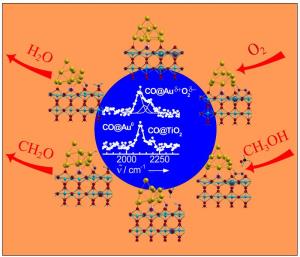
"Dass Nanopartikel aus Gold tatsächlich selektiv Methanol zu Formaldehyd umsetzen, ist bemerkenswert", sagt Prof. Dr. Martin Muhler vom Lehrstuhl für Technische Chemie der RUB. "Als beständiges Edelmetall sollte Gold eigentlich nicht als Katalysator geeignet sein." Doch Goldpartikel von wenigen Nanometern Größe, verankert an einer Titandioxidoberfläche, erfüllen ihren Dienst. Sie benötigen lediglich Sauerstoff, um die Reaktion in Gang zu bringen; als Abfall bleibt nur Wasser übrig. Wie das geht, untersuchte Muhlers Team gemeinsam mit den Gruppen von Prof. Dr. Dominik Marx vom Lehrstuhl für Theoretische Chemie und Dr. Yuemin Wang vom Lehrstuhl für Physikalische Chemie I.
Sauerstoff bindet an der Grenze zwischen Gold und Titandioxid
Die Chemiker identifizierten das aktive Zentrum des Katalysators, also die Stelle, an der Sauerstoff und Methanol binden und zu Wasser und Formaldehyd umgewandelt werden. Aufwändige Rechnungen von Dr. Matteo Farnesi Camellone zeigten, dass Sauerstoff an der Grenzfläche zwischen Titandioxid und Goldpartikeln bindet. Da Titandioxid ein Halbleiter und somit elektrisch leitend ist, kann es hier zu einem Ladungsaustausch zwischen Sauerstoff, Goldpartikeln und Titandioxid kommen. Sauerstoff-Fehlstellen im Titandioxid begünstigen diesen Ladungstransfer noch weiter. Elektronen gehen übergangsweise vom Katalysator auf das Sauerstoffmolekül über. Das ermöglicht die Bindung von Methanol an die Goldpartikel. In mehreren weiteren Reaktionsschritten bilden sich Formaldehyd und Wasser. Der Feststoff, der aus Gold und Titandioxid besteht, liegt am Ende des Reaktionszyklus im gleichen Zustand vor wie zu Beginn, verbraucht sich also nicht.
Experiment und Theorie: Nur die Kombination macht's möglich
Das RUB-Team klärte die einzelnen Reaktionsschritte im Detail auf. Die Forscher nutzten dazu Computersimulationen, sogenannte Dichtefunktionalrechnungen, und verschiedene Spektroskopieverfahren, nämlich Schwingungsspektroskopie (HREELS-Methode) und thermische Desorptionsspektroskopie. In seinen Modellrechnungen quantifizierte Dr. Farnesi den während der Katalyse stattfindenden Ladungsaustausch. Extrem sensitive schwingungsspektroskopische Messungen von Dr. Wangs Gruppe bestätigten die Konsequenzen des Ladungstransfers am realen System. "So konnten wir durch eine intensive Kooperation von Theorie und Experiment das aktive Zentrum und den gesamten Reaktionsmechanismus dieses komplexen Katalysators qualitativ und quantitativ erforschen", betont Prof. Marx.
Förderung
Die Studie entstammt dem Sonderforschungsbereich 558 "Metal-substrate interactions in heterogeneous catalysis", der Mitte 2012 auslief. "Die Ergebnisse sind sozusagen die Krönung der SFB-Arbeiten zur Alkoholoxidation", resümiert Muhler. Das Projekt wurde weiterhin aktiv gefördert durch das 2012 von der Deutschen Forschungsgemeinschaft genehmigte Exzellenzcluster "Ruhr Explores Solvation" RESOLV (EXC 1069), in dem Forscher die selektive Oxidation von Alkoholen in flüssiger Phase untersuchen.
Zusatzinformationen:
Dr. Matteo Farnesi Camellone, Dr. Jianli Zhao, Lanying Jin, Dr. Yuemin Wang, Prof. Dr. Martin Muhler, Prof. Dr. Dominik Marx:
Molecular Understanding of Reactivity and Selectivity for Methanol Oxidation at the Au/TiO2 Interface..
In: Angewandte Chemie; online veröffentlicht am 15. April 2013, DOI 10.1002/anie.201301868
Quelle: Ruhr-Universität Bochum, RUB
Aktualisiert am 30.04.2013.
Permalink: https://www.internetchemie.info/news/2013/apr13/au-tio2-katalysator.php
© 1996 - 2026 Internetchemie ChemLin