"Es ist ein wichtiger Schritt auf dem Weg zu einem umfassenden Verständnis der natürlichen Prozesse in einer atomaren Größenordnung." Dieses Fazit zieht eine Gruppe Würzburger Experimentalphysiker in einer neuen Publikation, die gerade in dem renommierten Journal "Nature Communications" erschienen ist [siehe unten].
Achim Schöll, Privatdozent am Lehrstuhl für Experimentelle Physik VII der Universität Würzburg, und seine Arbeitsgruppe haben gemeinsam mit Forschern aus Jülich und Triest einen Weg entdeckt, wie sich die räumliche Verteilung von Elektronen in einem Molekül experimentell bestimmen lässt.
Die Gesetze der Quantenmechanik
"Man muss sich der Gesetze der Quantenmechanik bedienen, wenn man die Vorgänge innerhalb eines Atoms oder eines Moleküls beschreiben will", erklärt Achim Schöll. Wer in der Schule mal gelernt hat, dass Elektronen den Atomkern auf exakten Bahnen umkreisen - wie der Mond die Erde -, kommt mit seiner Vorstellung in der quantenmechanischen Welt nicht weit. Dort werden Teilchen als komplexe Wellenfunktionen behandelt, zur Beschreibung ihrer Eigenschaften dienen die Amplitude und die Phase dieser Wellen.
Experimentell bestimmen lassen sich diese beiden Werte allerdings nur sehr schwer: "Es gehört zur Natur des Messprozesses, dass in der Regel die Information über die Phase verloren geht", sagt Schöll. Dies liegt daran, dass in den meisten Experimenten Intensitäten gemessen werden, die dem Quadrat der Wellenfunktion und damit der Aufenthaltswahrscheinlichkeit entsprechen. Dadurch geht die Information über die Phase, das heißt das Vorzeichen dieser Funktion , verloren.
Bisherige Experimente weisen Schwachstellen auf
Aus Sicht der Experimentalphysiker ist das unbefriedigend, schließlich ist die Phase bei so fundamentalen Prozessen wie der chemischen Bindung oder der Supraleitfähigkeit der entscheidende Wert. Nach einem Weg, diesen Wert im Experiment zu bestimmen, wird deshalb seit Jahren intensiv geforscht. Zwar gibt es bereits einige wenige Methoden, die es ermöglichen, die Phase zu bestimmen. "Mit diesen lässt sich allerdings nicht gleichzeitig die räumliche Verteilung der Elektronen ermitteln", sagt Schöll.
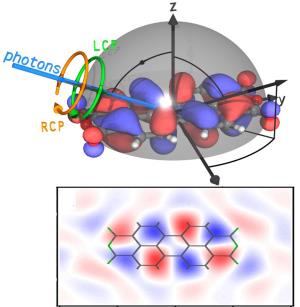
Das Würzburger Experiment
Dass es doch möglich ist, im Experiment zur gleichen Zeit die Phase und die Aufenthaltswahrscheinlichkeit zu bestimmen, haben Schöll und seine Mitarbeiter jetzt gezeigt. Mit Hilfe der winkelaufgelösten Photoelektronenspektroskopie und zirkular polarisiertem Licht konnten sie dies erreichen.
Bei der Photoelektronspektroskopie "beschießen" die Physiker ihre Probe mit UV- oder Röntgenlicht, welches Elektronen aus der Oberfläche der Probe auslöst. Aus der Austrittsrichtung und der kinetischen Energie dieser Elektronen können die Wissenschaftler beispielsweise Rückschlüsse auf die chemische Zusammensetzung und die elektronische Beschaffenheit des Festkörpers ziehen. Je nach Art der Untersuchung können sie außerdem dem Lichtstrahl besondere Eigenschaften mit auf den Weg geben. "Zirkular polarisiertes Licht" bedeutet in diesem Fall: Die Ebene, in der die Lichtwelle schwingt, dreht sich im Kreis - mal links, mal rechts herum.
Die Symmetrie liefert die gewünschte Information
"Je nachdem, ob wir unser Molekül mit rechts oder links zirkular polarisiertem Licht bestrahlen, treten unterschiedliche Intensitätsverteilungen auf", erklärt Schöll. Die Differenz dieser beiden Intensitäten, der sogenannte zirkulare Dichroismus, zeigt dann charakteristische Symmetrien, wenn die Einstrahlrichtung des Lichtes verändert wird. Daraus lässt sich die Phase der zugrunde liegenden Wellenfunktion ableiten. Zwar ergibt dieses Experiment die Phase ebenfalls nicht direkt. "Wir können aber die Symmetrie der Phase bestimmen und damit sagen, wo der Wert positiv und wo negativ ist", sagt der Physiker.
Kombiniert mit den Messergebnissen der Aufenthaltswahrscheinlichkeit gewinnen die Physiker somit ein Bild, das einem Schnitt durch ein Molekülorbital im Realraum gleicht. Und wer das Molekülorbital kennt, kennt gleichzeitig auch die Eigenschaften des Moleküls.
Zusatzinformationen:
M. Wiener, D. Hauschild, C. Sauer, V. Feyer, A. Schöll, F. Reinert:
Complete determination of molecular orbitals by measurement of phase symmetry and electron density.
In: Nature Communications; 5, 4156, online veröffentlicht am 09. Juni 2014, DOI 10.1038/ncomms5156
Quelle: Julius-Maximilians-Universität, Würzburg
Aktualisiert am 11.06.2014.
Permalink: https://www.internetchemie.info/news/2014/jun14/realraum-molekuelorbital.php
© 1996 - 2026 Internetchemie ChemLin