Stefan W. Hell vom Max-Planck-Institut für biophysikalische Chemie in Göttingen hat den diesjährigen Nobelpreis für Chemie 2014 erhalten. Er teilt sich den Preis mit Eric Betzig und William E. Moerner.
Hell gelang es, die bisherige Auflösungsgrenze optischer Mikroskope radikal zu unterlaufen - ein Durchbruch, der neue wegweisende Erkenntnisse in der biologischen und medizinischen Forschung ermöglicht.
"Ich saß an meinem Schreibtisch als mich der Anruf aus Stockholm erreichte und die Freude bei mir ist riesengroß, dass die Arbeit von mir und meinen Mitarbeitern die höchste Auszeichnung erfährt, die man als Wissenschaftler erhalten kann. Auch am Max-Planck-Institut für biophysikalische Chemie ist der Jubel groß. Max-Planck-Präsident Martin Stratmann gratulierte dem frisch gekürten Nobelpreisträger. "Das ist eine wunderbare Würdigung der Pionierarbeiten von Stefan Hell. Es wird ein Wissenschaftler ausgezeichnet, der den Mut hatte gegen viele Widerstände, ausgetretene Pfade zu verlassen und vermeintliche Glaubenssätze in Frage zu stellen. Nur so kann in der Wissenschaft wirklich Neues entstehen", sagte Max-Planck-Präsident Martin Stratmann. Stefan Hell ist der 18. Nobelpreisträger der Max-Planck-Gesellschaft. Damit haben nun vier Wissenschaftler des Max-Planck-Institut für biophysikalische Chemie die höchste wissenschaftliche Auszeichnung erhalten.
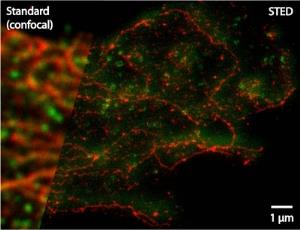
Mit seiner Erfindung der (Stimulated Emission Depletion)-Mikroskopie, die er 1999 experimentell realisierte, hat Stefan Hell die Lichtmikroskopie revolutioniert. Herkömmliche Lichtmikroskope haben eine Auflösungsgrenze, die durch die Wellennatur des Lichts bedingt ist: Objekte, die weniger als 200 Nanometer (millionstel Millimeter) voneinander entfernt sind, können nicht mehr getrennt wahrgenommen werden. Die von Ernst Abbe entdeckte Auflösungsgrenze - in einer Jenaer Gedenkstätte in Stein gemeißelt - galt für mehr als ein Jahrhundert für praktisch unumstößlich. Auch die häufig in der Biologie und Medizin eingesetzte Fluoreszenzmikroskopie musste bisher vor dieser Grenze halt machen. Dabei werden Moleküle der Zelle mit fluoreszierenden Farbstoffen markiert und mit Laserlicht einer bestimmten Wellenlänge gezielt "angeschaltet", sodass sie leuchten. Liegen die Moleküle enger beieinander als 200 Nanometer, verschwimmen sie allerdings auch hier zu einem verwaschenen Fleck. Für Biologen und Mediziner bedeutete dies eine massive Einschränkung - denn für sie sind weitaus kleinere Strukturen in lebenden Zellen interessant.
Der 51-jährige Physiker Stefan Hell hat als Erster einen Weg gefunden, die Abbesche Auflösungsgrenze von Lichtmikroskopen radikal zu unterlaufen - mit einem völlig neuen Konzept. Bei der von ihm erfundenen und zur Anwendungsreife entwickelten STED-Mikroskopie ist die Auflösung nicht länger durch die Lichtwellenlänge begrenzt. Dadurch ist es erstmals möglich, Strukturen in einer Zelle mit einer heute bis zu zehnmal besseren Detailschärfe im Vergleich zu herkömmlichen Fluoreszenzmikroskopen zu beobachten. "Ich hatte damals intuitiv gespürt, dass hier etwas noch nicht zu Ende gedacht wurde", erinnert sich Hell.
Er und sein Team wenden mit dem STED-Mikroskop einen Trick an, um dem Phänomen der Lichtbeugung ein Schnippchen zu schlagen. Hierbei wird einem Strahl, der die Fluoreszenzmoleküle anregt, ein zweiter Lichtstrahl, der STED-Strahl, hinterhergesandt. Dieser bewirkt genau das Gegenteil: Er regt die Moleküle sofort ab und hält sie so dunkel. Damit der STED-Strahl aber nicht alle Moleküle abschaltet, hat er in der Mitte ein Loch. Dadurch werden Moleküle am Rand des Anregungs-Lichtflecks dunkel, wohingegen Moleküle im Zentrum ungestört leuchten können. Die Helligkeit des STED-Strahls kann so eingestellt werden, dass die Ausdehnung des Bereichs, in dem die Moleküle fluoreszieren können, beliebig verringert werden kann. Mit einem gegenüber dem klassischen Fokus typischerweise um einen Faktor zehn verengten fluoreszierenden Bereich wird die Probe abgerastert und somit ein Bild erstellt.
Doch nicht nur Momentaufnahmen sind mit dem neuen STED-Mikroskop möglich. Sogar Lebensvorgänge im Inneren lebender Zellen lassen sich damit "live" mit Nanometer-Auflösung verfolgen. So gelang es dem Team um Hell, erstmals die Bewegungen von Botenstoff-Bläschen in einer Nervenzelle in Echtzeit zu "filmen" - mit 33 Bildern pro Sekunde und einer Auflösung von rund 70 Nanometern.
Mit seinen bahnbrechenden Arbeiten zu STED und weiteren damit verwandten Verfahren wie der 4Pi-Mikroskopie hat Stefan Hell in den vergangenen Jahren ein Fenster aufgestoßen, um weit in den Nanokosmos lebender Zellen vorzudringen. In der Erforschung von Krankheiten oder der Entwicklung von Medikamenten biete die STED-Mikroskopie reichlich Potenzial, betont Hell. "Wenn sich direkt beobachten lässt, wie ein Medikament in der Zelle wirkt, könnte die Entwicklungszeit neuer therapeutischer Wirkstoffe enorm verkürzt werden."
Zur Person
Stefan W. Hell (Jahrgang 1962) studierte in Heidelberg Physik. Nach seiner Promotion im Jahr 1990 in Heidelberg verfolgte er seine Ideen zunächst als "freier Erfinder". Nach seiner Zeit als Postdoktorand am European Molecular Biology Laboratory (EMBL) in Heidelberg ging er 1993 als Gruppenleiter nach Turku, Finnland. Dort entwickelte er das Prinzip der STED-Mikroskopie. Von Turku wechselte Hell 1997 als Leiter einer Max-Planck-Nachwuchsgruppe an das MPI für biophysikalische Chemie in Göttingen, wo er seit 2002 die Abteilung NanoBiophotonik leitet. Er ist Wissenschaftliches Mitglied der Max-Planck-Gesellschaft und Honorarprofessor für Experimentalphysik an der Georg-August-Universität Göttingen. Darüber hinaus leitet er die Abteilung Optische Nanoskopie am Deutschen Krebsforschungszentrum in Heidelberg.
Das Deutsche Krebsforschungszentrum veröffentlicht dazu:
Stefan Hell erhält Nobelpreis für Chemie
Nobelpreisträger am Max-Planck-Institut für biophysikalische Chemie in Göttingen und am Deutschen Krebsforschungszentrum: Stefan Hell erhält Nobelpreis für Chemie
Nach dem Nobelpreis für Medizin 2008 an Harald zur Hausen erhält in diesem Jahr zum zweiten Mal ein Forscher am DKFZ die höchste Auszeichnung der Wissenschaft: Professor Stefan Hell, Direktor am Max-Planck-Institut für Biophysikalische Chemie in Göttingen und gleichzeitig Abteilungsleiter am DKFZ, wurde für seine "Entwicklung hochauflösender Fluoreszenz-Mikroskopie" heute mit dem Nobelpreis für Chemie ausgezeichnet.
"Stefan Hell ist ein absoluter Ausnahmewissenschaftler", erklärt Professor Otmar D. Wiestler, Vorstandsvorsitzender des Deutschen Krebsforschungszentrums. "Es erfüllt uns mit großer Freude und Stolz, mit ihm nach Harald zur Hausen innerhalb weniger Jahre bereits den zweiten Nobelpreisträger am Deutschen Krebsforschungszentrum zu wissen." Die höchste wissenschaftliche Auszeichnung ist der Lohn für viele Jahre unermüdlicher Forschung, im Laufe derer Stefan Hell das Auflösungsvermögen der Lichtmikroskopie um das Zehnfache steigerte - also zehnmal kleinere Strukturen darstellen konnte, als man das bisher für möglich gehalten hatte. Er hat damit eine völlig neue Dimension der Mikroskopie erschlossen.
"Ich hatte schon während meiner Doktorarbeit den Eindruck, dass das Thema Auflösung in der Lichtmikroskopie noch nicht zu Ende gedacht ist", erinnert sich Stefan Hell. Damals galt für Lichtmikroskope noch die magische Auflösungsgrenze von 200 Nanometern, die Ernst Abbe bereits im Jahr 1873 in seinem berühmten Gesetz formulierte: Mindestens die Hälfte der Wellenlänge des sichtbaren Lichtes müssten zwei Punkte in der Brennebene des Objektivs auseinander liegen, um voneinander unterscheidbar zu sein. Erst 120 Jahre später, Anfang der 1990er Jahre, gelang es dem Physiker Stefan Hell, diese magische Grenze zu durchbrechen und den Grundstein für die Lichtmikroskopie mit Auflösungen auf der Nanoskala - also die Lichtnanoskopie - zu legen.
Als ersten Schritt erfand Hell 1990 das 4Pi-Mikroskop, bei dem das Licht statt von einer von zwei Seiten gleichzeitig auf das Objekt fällt. Damit konnte die Auflösung bereits um das Vier- bis Siebenfache gesteigert werden. Danach entwickelte er die "Stimulated Emission Depletion" (STED-)Mikroskopie, ein Verfahren, das die Eigenschaften von Fluoreszenz-Farbstoffen ausnützt, die man ohnehin zum Anfärben von Proteinen oder DNA verwendet. Damit lassen sich biologische Strukturen erkennen, die bis zu 2000-mal feiner sind als ein menschliches Haar (20 bis 50 Nanometer).
"Der Nobelpreis erfüllt mich mit großem Stolz und Dankbarkeit - er ist schließlich die höchste wissenschaftliche Auszeichnung, die ein Forscher erlangen kann", erklärt Stefan Hell, der im Deutschen Krebsforschungszentrum (DKFZ) die Abteilung "Optische Nanoskopie" leitet, "vor allem ist es für mich aber auch ein tolles Gefühl, zu erleben, dass das STED-Mikroskop die medizinische Grundlagenforschung enorm beflügelt." Zwar lassen sich auch mit Elektronen- oder Rastersondenmikroskopen Strukturen im Nanometerbereich erkennen. Allerdings müssen wir die Präparate für diese Techniken in hauchdünne Scheiben schneiden. Intakte oder sogar lebende Zellen kann man so unmöglich untersuchen. Die STED-Mikroskopie hingegen liefert auch Nanometer-genaue Einblicke in lebende Zellen."
Im Deutschen Krebsforschungszentrum setzen Hell und seine Mitarbeiter besonders leistungsfähige Varianten dieser neuen Verfahren für die biologische und medizinische Grundlagenforschung ein. So untersuchen sie, wie die Rezeptoren auf der Oberfläche von Viren verteilt sind, die für Infektionsprozesse entscheidend sind. Besonders schnelle Aufnahmetechniken können so physiologische Prozesse sichtbar machen, etwa den Transport oder das Freisetzen von Botenstoffen an Nervenenden - wofür gestern im Übrigen der Nobelpreis für Medizin vergeben wurde! Mit der Kombination aus STED- und 4Pi-Mikroskopie erreichen die Forscher zudem eine verbesserte räumliche Auflösung. So lassen sich Informationen über kleinste Details aus dem Inneren einer lebenden Zelle gewinnen - wie zum Beispiel bestimmte Proteine in kleinen Zellorganellen wie den Mitochondrien, den Energiezentralen der Zellen, verteilt sind.
Stefan W. Hell (Jahrgang 1962) promovierte 1990 an der Universität Heidelberg in Physik und arbeitete von 1991 bis 1993 am Europäischen Molekularbiologischen Laboratorium (EMBL) in Heidelberg. Danach folgte ein dreieinhalbjähriger Aufenthalt an den Universitäten Turku (Finnland) und Oxford (Großbritannien). Als Leiter einer Max-Planck-Nachwuchsgruppe wechselte er im Jahr 1997 an das Göttinger Max-Planck-Institut für biophysikalische Chemie. Seit 2002 ist er an diesem Institut Direktor und Leiter der Abteilung NanoBiophotonik. Zudem leitet er seit 2003 die Abteilung Optische Nanoskopie am Deutschen Krebsforschungszentrum in Heidelberg. Stefan Hell erhielt bereits zahlreiche hochrangige Preise, zuletzt erhielt er im September 2014 den Kavli-Preis für Nanowissenschaften, ein Jahr zuvor, im September 2013 die Carus-Medaille der Akademie für Naturwissenschaften Leopoldina. Im Jahr 2011 freute sich der Physiker über den Meyenburgpreis für Krebsforschung: "Das ist auf jeden Fall etwas Besonderes, weil es zeigt, dass unsere Forschung eine breitere Anwendung findet - und Krebs betrifft uns leider alle. Insofern wünsche ich mir sehr, und ich freue mich darauf, dass wir in Zukunft viele Einsichten bekommen, die helfen werden, Krebs zu bekämpfen."
Hell teilt sich den mit insgesamt rund 930 000 Euro dotierten Nobelpreis mit seinen amerikanischen Kollegen Eric Betzig vom Howard Hughes Medical Institute in Ashburn in den USA sowie William E. Moerner von der Stanford University in den USA.
Das Deutsche Krebsforschungszentrum (DKFZ) ist mit mehr als 3.000 Mitarbeiterinnen und Mitarbeitern die größte biomedizinische Forschungseinrichtung in Deutschland. Über 1000 Wissenschaftlerinnen und Wissenschaftler erforschen im DKFZ, wie Krebs entsteht, erfassen Krebsrisikofaktoren und suchen nach neuen Strategien, die verhindern, dass Menschen an Krebs erkranken. Sie entwickeln neue Methoden, mit denen Tumoren präziser diagnostiziert und Krebspatienten erfolgreicher behandelt werden können. Die Mitarbeiterinnen und Mitarbeiter des Krebsinformationsdienstes (KID) klären Betroffene, Angehörige und interessierte Bürger über die Volkskrankheit Krebs auf. Gemeinsam mit dem Universitätsklinikum Heidelberg hat das DKFZ das Nationale Centrum für Tumorerkrankungen (NCT) Heidelberg eingerichtet, in dem vielversprechende Ansätze aus der Krebsforschung in die Klinik übertragen werden. Im Deutschen Konsortium für Translationale Krebsforschung (DKTK), einem der sechs Deutschen Zentren für Gesundheitsforschung, unterhält das DKFZ Translationszentren an sieben universitären Partnerstandorten. Die Verbindung von exzellenter Hochschulmedizin mit der hochkarätigen Forschung eines Helmholtz-Zentrums ist ein wichtiger Beitrag, um die Chancen von Krebspatienten zu verbessern. Das DKFZ wird zu 90 Prozent vom Bundesministerium für Bildung und Forschung und zu 10 Prozent vom Land Baden-Württemberg finanziert und ist Mitglied in der Helmholtz-Gemeinschaft deutscher Forschungszentren.
Deutsche Forschungsgemeinschaft, DFG:
DFG gratuliert Stefan Hell zum Nobelpreis für Chemie
Die DFG gratuliert Professor Stefan W. Hell, Max-Planck-Institut für biophysikalische Chemie in Göttingen und Deutsches Krebsforschungszentrum in Heidelberg, zum Nobelpreis für Chemie 2014. Er erhält die Auszeichnung gemeinsam mit seinen amerikanischen Kollegen Eric Betzig und William E. Moerner "für die Entwicklung der hochauflösenden Fluoreszenz-Mikroskopie". Hell ist Leibniz-Preisträger 2008 und Sprecher eines DFG-Exzellenzclusters und bereits der ist der siebte Träger des Gottfried Wilhelm Leibniz-Preises der DFG, der auch den Nobelpreis erhält.
Die Deutsche Forschungsgemeinschaft (DFG) gratuliert Professor Stefan W. Hell, Max-Planck-Institut für biophysikalische Chemie in Göttingen und Deutsches Krebsforschungszentrum in Heidelberg, zum Nobelpreis für Chemie 2014. DFG-Präsident Professor Peter Strohschneider sagte am Rande des Treffens der Sprecherinnen und Sprecher der in der Exzellenzinitiative geförderten Graduiertenschulen, Exzellenzcluster und Zukunftskonzepte in Bad Honnef: "Die DFG gratuliert Professor Stefan W. Hell, den sie bereits 2008 mit ihrem Leibniz-Preis als herausragende Forscherpersönlichkeit gewürdigt hat und der in einem der DFG-Forschungszentren tätig ist, das inzwischen als Exzellenzcluster im Rahmen der Exzellenzinitiative gefördert wird. Die Auszeichnung für ihn ist nicht zuletzt eine großartige Bestätigung dafür, wie die Organisationen für die Förderung der universitären und außeruniversitären Spitzenforschung gemeinsam ein fruchtbares System schaffen, in dem solche hervorragenden erkenntnisgeleiteten Forschungen gedeihen können." Heute gab die Königliche Schwedische Akademie die Preisträger in der Chemie bekannt: Neben Hell erhalten seine amerikanischen Kollegen Eric Betzig und William E. Moerner den Nobelpreis "für die Entwicklung der hochauflösenden Fluoreszenz-Mikroskopie".
Professor Stefan W. Hell ist der siebte Träger des Gottfried Wilhelm Leibniz-Preises der DFG, der danach den Nobelpreis erhält - nach Hartmut Michel (Chemie, 1988), Erwin Neher und Bert Sakmann (Medizin, 1991), Christiane Nüsslein-Volhard (Medizin, 1995), Theodor Hänsch (Physik, 2005) sowie Gerhard Ertl (Chemie, 2007). Hell ist außerdem einer der Sprecher des DFG-geförderten Exzellenzclusters "Mikroskopie im Nanometerbereich und Molekularphysiologie des Gehirns", beteiligter Wissenschaftler an der ebenfalls in der Exzellenzinitiative geförderten "Göttinger Graduiertenschule für Neurowissenschaften, Biophysik und Molekulare Biowissenschaften" sowie Teilprojektleiter in den Sonderforschungsbereichen "Photonische Abbildungen auf der Nanometerskala" und "Modulatorische Einheiten bei Herzinsuffizienz" in Göttingen.
Schon beim Leibniz-Preis würdigte die Jury vor allem die Entwicklung der STED-Mikroskopie, mit der Hell die über ein Jahrhundert lang für unumstößlich gehaltenen Auflösungsgrenzen der besten Mikroskope überwand. Die Grundlage war eine wahrhaft grundlegende Überlegung zur Auflösung des konventionellen Laserscan-Mikroskops: Darin wird ein Laserstrahl auf das Untersuchungsobjekt fokussiert und die dabei im Fokus ausgelöste Fluoreszenz gemessen. Hells bahnbrechende Weiterentwicklung ging davon aus, dass die Auflösung wesentlich besser sein kann, wenn die Fluoreszenzanregung in der Peripherie des Fokus ausgeschaltet werden kann, bevor die angeregten Farbstoffmoleküle Fluoreszenz abgeben. Dies lässt sich durch eine stimulierte Anregungslöschung (STED - Stimulated Emission Depletion) erreichen. Mit diesem Ansatz gelang Hell bereits eine drei- bis viermal bessere Auflösung als mit den besten konventionellen Mikroskopen, und er konnte bei biologischen Anwendungen zum Beispiel erstmals die Fusion einzelner synaptischer Vesikel mit der Nervenendigung lichtmikroskopisch nachweisen. Die Bedeutung dieser Erfindung für die moderne Biologie, aber auch etwa für die Halbleiterindustrie ist kaum zu überschätzen, hieß es schon 2008.
Der wissenschaftliche Werdegang von Stefan W. Hell begann mit einem Physik-Studium und der Promotion in Heidelberg. Danach bezeichnete er sich zunächst als "freier Erfinder", schlug dann aber als Postdoktorand am European Molecular Biology Laboratory (EMBL) die wissenschaftliche Karriere ein. Als Leiter der Laser Microscopy Group der Universität Turku, Finnland, legte er die Grundlagen für die STED-Mikroskopie, die er ab 1996 als Nachwuchsgruppenleiter und ab 2002 als Direktor am Max-Planck-Institut für biophysikalische Chemie in Göttingen weiterentwickelte.
Der zuerkannte Preis wird wie in jedem Jahr am 10. Dezember in Stockholm verliehen.
Universität Duisburg-Essen:
Wie man einen Novbelpreis bekommt
Weil er gegen alle Widerstände unbeirrt nach Neuem gesucht hat, war seine Karriere so erfolgreich, fasste der neu ernannte Chemienobelpreisträger Stephan W. Hell, Direktor am Max-Planck-Institut für Biophysikalische Chemie in Göttingen, einmal rückblickend zusammen. Dass seine Karriere durchaus einem bestimmten Muster folgt, erläutert der Aufsatz "Chemiker machen Karriere. Und Chemikerinnen?" von Ute Pascher-Kirsch und Katrin Jansen in der Zeitschrift Gender. Die Diplom-Sozialwissenschaftlerinnen arbeiten am Rhein-Ruhr-Institut für Sozialforschung und Politikberatung (RISP) e. V. an der Universität Duisburg-Essen (UDE).
Stefan W. Hell hatte in Deutschland zunächst beruflich keine Chance. Ein Laborleiter sieht in seiner Idee kein Potenzial. "Es blieb mir nichts anderes übrig, als nach Finnland zu gehen." Aber auch dort "habe ich mich von Stipendium zu Stipendium gehangelt". Mit der Veröffentlichung seiner Forschungsergebnisse in einer Fachzeitschrift kamen der Durchbruch und damit auch die Genugtuung. Die Karriere wird zum Selbstläufer. Neun Rufe folgten Schlag auf Schlag hintereinander.
Erfolgreiche Einzelkarrieren in der Chemie wie diese, so Pascher-Kirsch und Jansen, haben eines gemeinsam: Sie werden als aus sich heraus motiviert dargestellt und eng an das wissenschaftliche Interesse der Personen gekoppelt. Ein Leben neben dem Beruf kommt in den Erzählungen nicht vor. Vorausgesetzt wird, dass es mit einem ortsunabhängigen Dasein vereinbar ist.
Karrieren in der Chemie erscheinen in den Fachjournalen als ein steiniger, hindernisreicher Weg ohne Privatleben. Die Besonderheiten der Kategorie Geschlecht wird nur bei den Frauen thematisiert. Realität ist, dass sich der sehr hohe Anteil an diplomierten und promovierten Chemikerinnen nicht in der Beschäftigungsstruktur widerspiegelt, so Pascher-Kirsch und Jansen in ihrer Untersuchung.
Fakt ist, dass Chemiker in Unternehmen durchschnittlich häufiger in höheren Positionen als ihre weiblichen Fachkollegen arbeiten. Sie verdienen auch deutlich weniger als männliche Beschäftigte mit vergleichbaren Abschlüssen. Insegsamt sind Chemikerinnen deutlich weniger erfolgreich, gemessen an ihrer beruflichen Position, ihrem Jahreseinkommen oder ihrer Personal- und Budgetverantwortung.
Zusatzinformationen:
Quelle: Max-Planck-Gesellschaft zur Förderung der Wissenschaften e.V.
Siehe auch:Nobelpreis für Chemie 2014. Offizielle Mitteilung und Informationen der Königlich-Schwedischen Akademie der Wissenschaften vom 08. Oktober 2013.
Aktualisiert am 08.10.2014.
Permalink: https://www.internetchemie.info/news/2014/oct14/nobelpreis-chemie-2014.php
© 1996 - 2026 Internetchemie ChemLin