Zum Wachsen brauchen Pflanzen Stickstoff und Kohlenstoff. Dank der Photosynthese beziehen Pflanzen letzteren aus der Luft, doch Stickstoff müssen sie in Form von organischen Molekülen wie Ammoniak oder Harnstoff über die Wurzeln aufnehmen. Auch wenn Stickstoff 80 Prozent des Volumens der Erdatmosphäre ausmacht, kann die Pflanze erst in gebundener Form darauf zugreifen. In der Landwirtschaft wird deswegen Dünger verwendet, der Stickstoff für Pflanzen bereitstellt. Die einzigen Lebewesen, die Stickstoff aus der Luft in nutzbare Moleküle umwandeln können, sind Mikroorganismen - zum Beispiel Knöllchenbakterien. Sie besitzen das Enzym Nitrogenase, das den Stickstoff mit Wasserstoff zu Ammonium verbindet.
Prof. Dr. Oliver Einsle und Dr. Thomas Spatzal haben nicht nur die Funktionsweise des Enzyms weiter aufgeklärt, sondern auch einen einzigartigen Mechanismus beschrieben, mit dem es Kohlenwasserstoffe produziert.
"Wir wollen die Reaktionen in der Nitrogenase verstehen, um sie in Zukunft biotechnologisch nutzbar zu machen. Derzeit kann die Hälfte der Menschheit nur mit dem Einsatz von Düngemitteln in der Landwirtschaft ernährt werden. Das verbraucht etwa ein Prozent der Weltenergieproduktion", erklärt Einsle. Die Forscher zeigten zum ersten Mal, wie Nitrogenase Kohlenstoff mit Wasserstoff verbindet. Dabei entstehen Moleküle, die Biotreibstoffen ähneln. "Somit wird das Enzym auch für die nachhaltige Energieproduktion interessant", so Einsle.
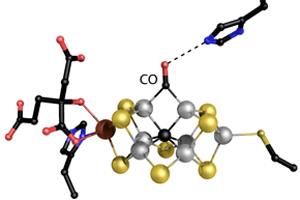
Einsle erforscht die Feinstruktur des Herzstücks des Enzyms: ein großes Metallzentrum namens Eisen-Molybdän-Cofaktor (FeMoco). Einsle, Spatzal, und Prof. Dr. Douglas Rees Pasadena/USA erstellten eine Kristallstruktur, die zeigt, wie ein Kohlenmonoxid-Molekül (CO) an FeMoco bindet. "Dort verdrängt es unerwarteter Weise ein Schwefelatom, das vorher die gleiche Position in dem Metallzentrum besetzt hatte. Damit ergeben sich erstmals Rückschlüsse darauf, wie das Zentrum mit anderen Molekülen reagiert", beschreibt Einsle die Ergebnisse, die in der Fachzeitschrift Science erschienen [siehe Literatur-Hinweis unten].
"Eine derartige chemische Umlagerung wurde in einem biologischen System nie zuvor beobachtet", erklärt Einsle weiter. Seit 2010 ist bekannt, dass CO die Nitrogenase hemmt und dass das Enzym das Gas in geringem Maße in Kohlenwasserstoffe umwandelt. Indem die Forscher das Enzym während der Stickstoffreaktion mit CO begasten, fanden sie eine Bindestelle für CO und konnten die Umlagerung dokumentieren. Neben dem sogenannten "Haber-Bosch-Prozess der Stickstofffixierung" fördert die Nitrogenase somit auch eine Reaktion, die der "Fischer-Tropsch-Synthese von Kohlenwasserstoffen" entspricht, mit der großtechnisch Treibstoffe zum Beispiel aus Industrieabgasen nachhaltig synthetisiert werden können. "Die neue Strukturanalyse beschreibt erstmals den Mechanismus dieser ungewöhnlichen Reaktivität", so Einsle.
Oliver Einsle ist Professor am Institut für Biochemie der Universität Freiburg und Mitglied des Exzellenzclusters BIOSS Centre for Biological Signalling Studies der Universität Freiburg. Thomas Spatzal hat seine Doktorarbeit in Freiburg beendet und forscht nun am California Institute of Technology, in Pasadena/USA mit Douglas Rees.
Zusatzinformationen:
Thomas Spatzal, Kathryn A. Perez, Oliver Einsle, James B. Howard, Douglas C. Rees:
Ligand binding to the FeMo-cofactor: Structures of CO-bound and reactivated nitrogenase.
In: Science; Vol. 345 no. 6204 pp. 1620-1623, 26. September 2014, DOI 10.1126/science.1256679
Quelle: Albert-Ludwigs-Universität, Freiburg im Breisgau
Aktualisiert am 28.09.2014.
Permalink: https://www.internetchemie.info/news/2014/sep14/nitrogenase-feinstruktur.php
© 1996 - 2026 Internetchemie ChemLin