Antimonpentachlorid - auch Antimon(V)-chlorid - ist eine anorganisch-chemische Verbindung aus den Elementen Antimon in der fünfwertigen Stufe und Chlor, die erstmals 1825 von dem deutschen Chemiker und Mineralogen Heinrich Rose in einem wissenschaftlichen Artikel erwähnt wurde.
Bezeichnungen und Identifikatoren
Antimonpentachlorid
Cl5Sb
SbCl5
299,01 (g/mol)
7647-18-9
231-601-8
VMPVEPPRYRXYNP-UHFFFAOYSA-I
Weitere Bezeichnungen, Synonyme
Antimon(V)-chlorid; Antimonsuperchlorid; Pentachlorstiban
Englische Bezeichnung
Antimony pentachloride
Antimony(V) chloride; Antimonic chloride; Antimony perchloride; Pentachlorostiborane; Pentachloroantimony
Chemische Formeln
Brutto- bzw. Summenformel und Strukturformel der chemischen Verbindung Antimonpentachlorid:
-chlorid.png)
Cl5Sb oder SbCl5
Mr = 299,01 g/mol
SMILES: Cl[Sb](Cl)(Cl)(Cl)Cl
Daten und Eigenschaften
Übersicht über die (bekannten) chemischen und physikalischen Eigenschaften: Antimonpentachlorid. Es gelten - soweit nicht anders angegeben - Raumumgebungsbedingungen (Normaldruck, 0 % Luftfeuchtigkeit, 20 °C).
Unter Standardbedingungen liegt reinstes Antimonpentachlorid in Form einer farblosen, öligen, an der Luft rauchenden und stechend riechenden Flüssigkeit vor, die häufig durch Verunreinigungen oder Zersetzung gelblich oder rotgelblich gefärbt ist. In festem Zustand farblose monokline Kristalle, die bei etwa 3 °C schmelzen. Die Chemikalie wirkt stark korrosiv gegenüber Metallen, auch Edelstahl, und fluorierten Kunststoffen. In überschüssigem Wasser erfolgt Hydrolyse zu HCl und Antimontrioxid. Lagerung in Glas- oder PTFE- Behältern.
+ Löslich in Salzsäure und Chloroform, Schwefelkohlenstoff etc. sowie in einer wässrigen Weinsäure-Lösung. Zersetzung bei Kontakt mit Wasser.
2,77 °C
175 °C
2,336 g cm-3 bei 20 °C
0,1333 kPa bei 22,7 °C
4 kPa bei 40 °C
2,034 cP bei 29,4 °C
15 dyn/cm bei 20 °C
nD = 1,59255 bei 22 °C
-437,2 kJ/mol bei 25 °C
295 J/(mol K) bei 25 °C
-345,35 kJ/mol
0,1209 kJ/(mol K)
1,14 bei 16,3 °C
-120,0 × 10-6 cm3 mol-1
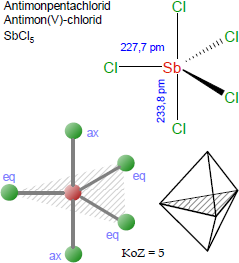
Gasförmiges Antimonpentachlorid hat eine trigonal-bipyramidale Struktur [vgl. Abbildung oben].
Spektroskopische Daten:
Prozentuale und isotopische Zusammensetzung:
Massenbezogene elementare Zusammensetzung und Isotopen-Anteile der Verbindung Antimonpentachlorid - Cl5Sb - berechnet auf Grundlage der Molekülmasse.
.Element E
der Atome Ex
und der Isotope *
der Isotope
Ex an Formelmasse
Chlor
ΣAr = 177,25 u
35Cl: 34,96885 u [75,80 %]
36Cl: 35,96831 u [<< 1 %]
37Cl: 36,9659 u [24,2 %]
35Cl: 44,93345 %
36Cl: Spuren
37Cl: 14,34551 %
Antimon
121Sb: 120,90381 u [57,21 %]
123Sb: 122,90421 u [42,79 %]
121Sb: 23,29651 %
123Sb: 17,42454 %
*) Die dritte Spalte führt die Atommassen bzw. Isotopenmassen der beteligten Elemente sowie - in eckigen Klammern - die natürliche Isotopenzusammensetzung auf.
Weitere berechnete Daten
Die molare Masse ist M = 299,01 Gramm pro Mol.
Die Stoffmenge von einem Kilogramm der Substanz ist n = 3,344 mol.
Die Stoffmenge von einem Gramm der Substanz ist n = 0,003 mol.
Monoisotopische Masse: 295,7480735 Da - bezogen auf 35Cl5121Sb.
Synthese, Gewinnung
Die Synthese der Antimon-Verbindung erfolgt technisch durch Überleiten von Chlorgas über geschmolzenes Antimontrichlorid bei etwa 80 °C und anschließender Vakuum-Destillation zur Gewinnung des hochreinen Produkts:
SbCl3 + Cl2 → SbCl5.
Möglich ist auch die Chlorierung von Antimonoxiden oder -sulfiden.
Verwendung
Antimonpentachlorid ist eine starke Lewis-Säure und ein nützlicher Chlor-Überträger in chemischen Chlorierungs-Reaktionen, beispielsweise beim Ersatz eines Fluorsubstituenten durch Chlor in organischen Verbindungen. Weitere Anwendungsgebiete: Polymerisations-Katalysator; Gewinnung von hochreinem Antimon-Metall.
Gefahren-Hinweise nach GHS
(Allgemeine Hinweise ohne Gewähr auf Richtigkeit und Vollständigkeit! Die Angaben ersetzen weder das Sicherheitsdatenblatt Chemikalien noch eine Gefährdungsbeurteilung, sondern geben eine allgemeine Übersicht hinsichtlich der Gefährdung durch den Gefahrstoff.)


Signalwort: Gefahr
Gefahrenhinweise (H-Sätze):
H314Verursacht schwere Verätzungen der Haut und schwere Augenschäden.
H411
Giftig für Wasserorganismen, mit langfristiger Wirkung.
LD50 (Ratte, oral): 1115 mg/kg.
Kennzeichnung in der EU: Siehe ECHA Substance Infocard 100.028.729.
Beförderung gefährlicher Güter (Gefahrgut-Kennzeichnung): UN-Nummer 1730.
Externe Informationsquellen
Hersteller und Bezugsquellen
In der nachfolgenden Tabelle sind Produzenten und Lieferanten von Antimonpentachlorid als kommerzielle Chemikalie für Labor, Forschung, Industrie und Produktion mit den entsprechenden Kontaktdaten verzeichnet.
Literatur und Quellen
[1] - Heinrich Rose:
Über die Verbindungen des Antimons mit Chlor und Schwefel.
In: Annalen der Physik, (1825), DOI 10.1002/andp.18250790404.
Letzte Änderung am 12.02.2024.
Permalink: https://www.internetchemie.info/substanz/Antimonpentachlorid.php
© 1996 - 2024 Internetchemie ChemLin