Antimontribromid ist eine binäre anorganisch-chemische Verbindung aus den Elementen Antimon der Oxidationsstufe +III und Brom.
Bezeichnungen und Identifikatoren
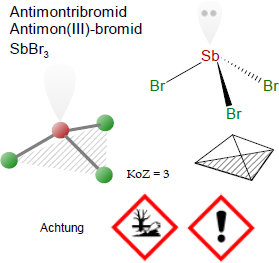
Antimontribromid
Br3Sb
SbBr3
361,472 (g/mol)
7789-61-9
232-179-8
RPJGYLSSECYURW-UHFFFAOYSA-K
Weitere Bezeichnungen, Synonyme
Antimon(III)-bromid; Tribromstibin; Tribromstiban; Antimonbromid
Englische Bezeichnung
Antimony tribromide
Antimony(III) bromide; Tribromostibine; Antimonous bromide; Tribromostibane
Chemische Formeln
Brutto- bzw. Summenformel und Strukturformel der chemischen Verbindung Antimontribromid:
Br3Sb oder SbBr3
Mr = 361,472 g/mol
SMILES: Br[Sb](Br)Br
Daten und Eigenschaften
Übersicht über die (bekannten) chemischen und physikalischen Eigenschaften: Antimontribromid. Es gelten - soweit nicht anders angegeben - Raumumgebungsbedingungen (Normaldruck, 0 % Luftfeuchtigkeit, 20 °C).
Antimontribromid ist unter Standardbedingungen und in reiner Form ein gelber, orthorhombisch-kristalliner, hygroskopischer, langsam zerfliessender Feststoff, der sich unter dem Einfluss von Licht, Alkohol und Wasser zersetzt. In geschmolzenem Zustand ist die Chemikalie eine bernsteingelbe Flüssigkeit. Die Substanz wird auch als Lösung in Bromwasserstoffsäure gehandelt.
Kritische Temperatur: 904,5 °C; kritischer Druck: 56 atm; Kryoskopische Konstante: 26,7; spezifische Wärme: 0,0709 bei 33 °C.
+ Löslich in verdünnter Salzsäure, Bromwasserstoffsäure, Schwefelkohlenstoff, Aceton, Benzol, Chloroform, Ammoniak.
- In Wasser erfolgt Hydrolyse.
96,6 °C
280 °C
4,148 g cm-3 bei 23 °C
nD = 1,74 bei 20 °C
-259 kJ/mol bei 25 °C
53,2 kJ/mol bei 560 °C
-9,7 cal/g
0,096 kJ/(mol K)
2,47
-115,0 × 10-6 cm3 mol-1
Bei der Kristallisation des Antimonbromids aus Schwefelkohlenstoff wurden zwei Kristallmodifikationen erhalten, von denen die Beta-Variante die stabilere ist. α-Antimonbromid kristallisiert in Nadeln aus warmem CS2, wenn die Lösung rasch abgekühlt wird.
α-SbBr3: Rhombisches System, Raumgruppe P212121 Nr. 19 mit den Zellparametern a = 1012 pm, b = 1230 pm, c = 442 pm.
β-SbBr3: Rhombisches System, Raumgruppe Pbnm Nr. 62 (3) mit a = 668 pm, b = 825 pm, c = 996 pm, Z = 4.
Prozentuale und isotopische Zusammensetzung:
Massenbezogene elementare Zusammensetzung und Isotopen-Anteile der Verbindung Antimontribromid - Br3Sb - berechnet auf Grundlage der Molekülmasse.
.Element E
der Atome Ex
und der Isotope *
der Isotope
Ex an Formelmasse
Brom
ΣAr = 239,712 u
79Br: 78,91834 u [50,65 %]
81Br: 80,9169 u [49,35 %]
79Br: 33,58881 %
81Br: 32,7267 %
Antimon
121Sb: 120,90381 u [57,21 %]
123Sb: 122,90421 u [42,79 %]
121Sb: 19,2709 %
123Sb: 14,41359 %
*) Die dritte Spalte führt die Atommassen bzw. Isotopenmassen der beteligten Elemente sowie - in eckigen Klammern - die natürliche Isotopenzusammensetzung auf.
Weitere berechnete Daten
Die molare Masse ist M = 361,472 Gramm pro Mol.
Die Stoffmenge von einem Kilogramm der Substanz ist n = 2,766 mol.
Die Stoffmenge von einem Gramm der Substanz ist n = 0,003 mol.
Monoisotopische Masse: 357,658824 Da - bezogen auf 79Br3121Sb.
Synthese, Gewinnung
Das Antimonbromid kann durch die Reaktion metallischem Antimon mit elementarem Brom sowie durch die Umsetzung von Antimontrioxid mit Bromwasserstoffsäure hergestellt werden. Eine weitere Methode ist die Synthese durch Einwirkung von Brom auf eine Mischung aus Antimontrisulfid und Antimontrioxid bei 250 °C.
Verwendung
Antimontribromid kann zur Herstellung anderer Antimon-Verbindungen, in der chemischen Analyse, bei speziellen Beiz- und Färbe-Verfahren sowie als Flammschutzmittel (z. B. für Polyethylen) verwendet werden.
Gefahren-Hinweise nach GHS
(Allgemeine Hinweise ohne Gewähr auf Richtigkeit und Vollständigkeit! Die Angaben ersetzen weder das Sicherheitsdatenblatt Chemikalien noch eine Gefährdungsbeurteilung, sondern geben eine allgemeine Übersicht hinsichtlich der Gefährdung durch den Gefahrstoff.)


Signalwort: Achtung
Gefahrenhinweise (H-Sätze):
H302Gesundheitsschädlich bei Verschlucken.
H332
Gesundheitsschädlich bei Einatmen.
H411
Giftig für Wasserorganismen, mit langfristiger Wirkung.
Kennzeichnung in der EU: Siehe ECHA Substance Infocard 100.029.254.
Beförderung gefährlicher Güter (Gefahrgut-Kennzeichnung): UN-Nummer 1549.
Externe Informationsquellen
Hersteller und Bezugsquellen
In der nachfolgenden Tabelle sind Produzenten und Lieferanten von Antimontribromid als kommerzielle Chemikalie für Labor, Forschung, Industrie und Produktion mit den entsprechenden Kontaktdaten verzeichnet.
Literatur und Quellen
[1] - D. W. Cushen, R. Hulme:
The crystal and molecular structure of antimony tribromide: β-antimony tribromide.
In: Journal of the Chemical Society, (1962), DOI 10.1039/JR9620002218.
[2] - D. W. Cushen, R. Hulme:
The crystal and molecular structure of antimony tribromide: α-antimony tribromide.
In: Journal of the Chemical Society, (1964), DOI 10.1039/JR9640004162.
Letzte Änderung am 12.02.2024.
Permalink: https://www.internetchemie.info/substanz/Antimontribromid.php
© 1996 - 2024 Internetchemie ChemLin