|
|
|
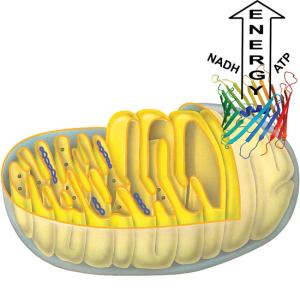
Die Kraftstoffpipeline der Zelle, der VDAC-Transportkanal, versorgt die Zelle mit lebenswichtiger Energie. Der Kanal ist in 19 Stränge gefaltet, die eine oben und unten offene Fassform ausbilden.
Bildquelle - Struktur: Zweckstetter, MPIbpc, Mitochondrium: Linder Biologie, 22. Auflage; mit freundlicher Genehmigung des Schroedel-Verlages
|
Ohne Energie geht auch in lebenden Zellen gar nichts. Damit Zellen ihre vielfältigen Aufgaben erfüllen können, müssen ihre "Kraftwerke" fortlaufend Energie erzeugen. Diese wird in Form der zellulären Energiewährung (sogenanntes ATP) über die beiden Hüllmembranen der Mitochondrien zu jedem Ort der Zelle transportiert. Bis zu 75 kg ATP verbraucht ein Mensch pro Tag. Als Haupt-Transportweg durch die äußere Hüllmembran der Mitochondrien dient dabei ein großer Proteinkanal, das Porin (VDAC). Doch dient der Kanal keineswegs nur dem Transport lebenswichtiger Energie und Stoffwechselprodukte. Anweisung zum Zell-Selbstmord verschicken Neben ihrer Aufgabe als Energielieferant der Zelle spielen Mitochondrien eine entscheidende Rolle beim programmierten Zell-Selbstmord, der Apoptose. Auch die "Kommandos" zum programmierten Zelltod werden über den VDAC-Kanal verschickt. Dazu werden über den VDAC-Kanal bestimmte Proteine aus den Mitochondrien in das Zellinnere transportiert, die dort "Killer-Proteine" aktivieren. Diese bewirken das Absterben der gesamten Zelle, ohne benachbarte Zellen zu schädigen. Ein derartiger Mechanismus ist beispielsweise in der Embryonalentwicklung wichtig. Auch die Linse in unserem Auge besteht aus toten Zellen und jede Stunde sterben Milliarden von Zellen in Knochenmark und Darmepithel. Der Zell-Selbstmord erlaubt dem Körper aber auch, sich gegen die Ausbreitung von Krebszellen zu schützen. Nicht zuletzt scheint Apoptose bei neurodegenerativen Erkrankungen wie der Alzheimer- und Parkinson-Krankheit eine Rolle zu spielen. Max-Planck-Forschern ist es jetzt gelungen, die Struktur dieses lebenswichtigen Transportkanals zu entschlüsseln. Eine erste experimentelle Hürde meisterten die Nachwuchswissenschaftler Monika Bayrhuber vom Max-Planck-Institut für biophysikalische Chemie und Thomas Meins vom Max-Planck-Institut für Biochemie. Ihnen gelang es, das VDAC-Protein aus seiner festen Verankerung mit der Hüllmembran zu lösen. Zum Ziel führte die Wissenschaftler aber erst die Kombination zweier unterschiedlicher strukturbiologischer Methoden, der Kernspinresonanzspektroskopie und der Röntgenkristallographie. Die Ergebnisse setzte Michael Habeck vom Max-Planck-Institut für biologische Kybernetik schließlich geschickt zur richtigen Struktur zusammen. Sie erlaubt den Forschern wichtige Aufschlüsse über die mögliche Funktionsweise des Transportkanals beim Menschen. Wie ein Fass ohne Deckel und Boden "Völlig überraschend für uns war, dass sich der Transportkanal in menschlichen Zellen grundlegend von verwandten Transportproteinen aus Bakterien unterscheidet", erklärt Gruppenleiter Markus Zweckstetter vom Göttinger Max-Planck-Institut für biophysikalische Chemie. Die lange Proteinkette ist in 19 Stränge gefaltet; sie bildet eine Fassform aus, die oben und unten offen ist. Diese Anordnung sollte es nach Lehrbuch-Meinung gar nicht geben. "Gerade die ungerade Anzahl der Stränge könnte funktionell das Entscheidende sein", erläutert Strukturbiologe Kornelius Zeth vom Max-Planck-Institut für Entwicklungsbiologie in Tübingen. Die Forscher vermuten, dass der Kanal durch die ungerade Anzahl an Strängen eine Instabilität erhält, die so die Regulation zwischen offenem und geschlossenem Zustand erleichtern könnte. "Unser Ziel ist es nun, kleine Moleküle zu finden, die die Struktur des VDAC derart beeinflussen, dass sich der Kanal nicht mehr öffnen oder schließen kann", erklärt der Göttinger Chemiker Christian Griesinger. Derartige Moleküle könnten zukünftig wichtige Impulse zur Medikamentenentwicklung liefern, um Autoimmunerkrankungen und neurodegenerativen Krankheiten zu behandeln - Krankheiten, bei denen der unkontrollierte Zell-Selbstmord einen wichtigen Part zu übernehmen scheint. [cr]
|