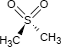
Die in reinem Zustand farblose, feste, kristalline Substanz löst sich mäßig in Wasser, schmilzt bei etwa 109 Grad Celsius und ist gegen Umwelteinflüsse stabil.
Vorkommen
Methylsulfonylmethan kommt natürlich in einigen Pflanzen vor, ist in kleinen Mengen in vielen Lebensmitteln und Getränken vorhanden und wird als Nahrungsergänzungsmittel vermarktet. So enthalten beispielsweise Milch und Kaffeebohnen 3 bzw. 1,5 mg pro kg MSM.
Verwendung
Aufgrund seiner Polarität und thermischen Stabilität wird Methylsulfonylmethan industriell als Hochtemperatur-Lösungsmittel für anorganische und organische Stoffe eingesetzt und dient gelegentlich als Medium für spezielle organische Synthesen.
Als so genannter Organischer Schwefel ist MSM als Nahrungsergänzungsmittel auf dem Markt - und verspricht allerlei positive gesundheitliche Vorteile für Mensch, Pferd und Tier. Hauptziel sei der Ausgleich eines Schwefelmangels im Körper. Über tatsächliche gesundheitliche Wirkungen wird derzeit viel diskutiert. Sicher scheint, dass die chemische Substanz - in vernünftigen Mengen eingenommen - keine gesundheitlichen Nachteile bringt.
Synthese
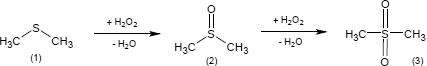
Die Produktion von Dimethylsulfon (3) geht entweder vom Dimethylsulfoxid (2) oder - eine Stufe früher - vom Dimethylsulfid (1) aus. Die genannten Ausgangsverbindungen werden mit Wasserstoffperoxid oxidiert, wobei unter Wasserabspaltung das synthetische Produkt entsteht.
Datenblatt: Methylsulfonylmethan
Quellen und weitere Informationen:
[1] - Georges Hareau, Philip Kocienski:
Dimethyl Sulfone.
In: e-EROS Encyclopedia of Reagents for Organic Synthesis, (2001), DOI 10.1002/047084289X.rd371.
[2] - K. Horvath, P. E. Noker, S. Somfai-Relle, R. Glavits, I. Financsek, A. G. Schauss:
Toxicity of methylsulfonylmethane in rats.
In: Food and Chemical Toxicology, (2002), DOI 10.1016/S0278-6915(02)00086-8.
Kategorie: Naturstoffe
Aktualisiert am 22.11.2018.
Permalink: https://www.internetchemie.info/chemie-lexikon/stoffe/m/methylsulfonylmethan.php
© 1996 - 2026 Internetchemie ChemLin