Derzeit vergeht kaum eine Woche, in der der Rohölpreis nicht eine neue Rekordmarke durchbricht. Für Heizöl und Benzin müssen die Verbraucher stets tiefer in die Tasche greifen. Strom und Gas werden immer teurer. Die steigenden Energiekosten treffen jedoch nicht nur Privathaushalte. "Längst ist der Faktor Energie auch zur bestimmenden Kostengröße in der chemischen Industrie geworden", weiß Prof. Dr. Winfried Plass von der Friedrich-Schiller-Universität Jena.
"Energie wo es geht einzusparen, ist deshalb ein Gebot der Stunde", so der Lehrstuhlinhaber für Anorganische Chemie weiter.
Dazu holen sich Prof. Plass und seine Kollegen Anregungen aus der Natur: Viele chemische Reaktionen, die im Labor nur mit hohem Energieaufwand - etwa unter hohem Druck oder bei hoher Temperatur - ablaufen, finden in der Natur zielgerichtet und hocheffizient auch bei niedriger Temperatur und Normaldruck statt. Grund dafür ist das Wirken von Enzymen - Eiweiß-Molekülen mit katalytischen Eigenschaften. Deren Reaktionsmechanismen zu entschlüsseln und diese so für mögliche Anwendungen nutzbar zu machen, ist das Ziel der Jenaer Chemiker. Jetzt ist ihnen dabei ein wichtiger Schritt gelungen.
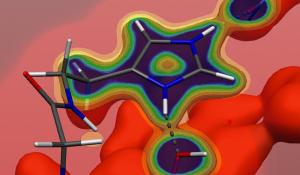
Mit Hilfe von Hochleistungs-Computern simulieren Prof. Plass und sein Team die während der Enzym-Katalyse ablaufenden molekularen Mechanismen. Dabei haben sie sich auf eine Gruppe von Enzymen konzentriert, die die Oxidation von Halogeniden, wie Chlorid oder Bromid, katalysieren. "Die Enzyme beschleunigen diese Reaktionen um den Faktor 100.000 bis 10.000.000", so Prof. Plass. Entscheidend dafür, so fanden die Jenaer Chemiker heraus, sind zwei Faktoren. "Zum einen bildet das Enzym-Eiweiß eine Art Tasche", erläutert Plass, "in der die beteiligten Ausgangsverbindungen in unmittelbare Nähe zusammengebracht werden." Zum anderen enthalten die "Haloperoxidasen" genannten Enzyme als zentralen Bestandteil ein Metallat-Ion: Vanadat. Dabei halten wichtige Seitenketten des Eiweißes dieses Ion für die chemische Umsetzung in einer günstigen Position, was die Reaktion ebenfalls begünstigt.
Die Vanadat-Haloperoxidasen enthalten das Übergangsmetall Vanadium und kommen in der Natur z. B. in Braunalgen vor. "Auch Pilze und Flechten nutzen diese Enzyme als Werkzeuge, um anderes Pflanzenmaterial - etwa die Rinde von Bäumen - "aufzubrechen" und so an Nährstoffe zu gelangen", so Plass. Denn im Verlauf der katalysierten Reaktion entstehen hochreaktive Verbindungen, die andere Substanzen angreifen können.
Auf diesem Gebiet könnte auch eine der möglichen Anwendungen dieses Wissens liegen. "Denkbar wäre zum Beispiel Katalysatoren zu entwickeln, die in Schiffsanstrichen Verwendung finden", sagt Prof. Plass. Diese könnten - dank der reaktiven Substanzen - den Bewuchs der Schiffe mit Algen verhindern. Doch das, so betont der Chemiker, sei noch reine Zukunftsmusik.
Zusatzinformationen:
Alison Butler:
Vanadium haloperoxidases.
In: Current Opinion in Chemical Biology; Volume 2, Issue 2. April 1998, Seiten279-285, DOI 10.1016/S1367-5931(98)80070-7
Quelle: Friedrich-Schiller-Universität, FSU, Jena
Aktualisiert am 29.05.2008.
Permalink: https://www.internetchemie.info/news/2008/may08/vanadat-haloperoxidasen.php
© 1996 - 2026 Internetchemie ChemLin