Gesundheit und Wohlbefinden hängen entscheidend davon ab, dass der Haushalt der Schilddrüsenhormone nicht aus dem Gleichgewicht gerät. Forschungsgruppen an den Universitäten Bayreuth und Bonn haben nun in Kooperation mit der Charité-Universitätsmedizin Berlin die Struktur und den Mechanismus eines wichtigen Enzyms entschlüsselt, mit dem die Körperzellen ihren Schilddrüsenhormonspiegel steuern.
Die Ergebnisse wurden online im Wissenschaftsmagazin 'Proceedings of the National Academy of Sciences of the United States of America' vorgestellt [siehe Hinweis unten].
Bei einer Schilddrüsen-Unterfunktion läuft der Stoffwechsel langsamer ab als normal, Betroffene fühlen sich schlapp. Bei Kindern kann dies auch zu geistiger Behinderung und Verzögerungen der körperlichen Entwicklung führen. Wird dagegen zu viel vom Schilddrüsenhormon Thyroxin produziert, kommt es zu Herzrasen, vermehrtem Schwitzen, Nervosität und Gewichtsverlust. "Bei Erwachsenen ist das Schilddrüsenhormon das Gaspedal des Stoffwechsels", erklärt Prof. Dr. Ulrich Schweizer vom Institut für Biochemie und Molekularbiologie des Universitätsklinikums Bonn.
Wenn die Schilddrüse das Hormon Thyroxin produziert, braucht sie Iod. Thyroxin enthält vier Iod-Atome und wird deshalb auch T4 genannt. Es ist jedoch nicht das eigentlich aktive Hormon, sondern ein Vorläufer. "Die Zellen des Körpers haben die Möglichkeit, sich ihren Schilddrüsenhormonspiegel selbst maßzuschneidern", erläutert Prof. Schweizer. Dabei kommen spezielle Enzyme - so genannte Deiodasen - zum Einsatz. Indem sie aus dem Thyroxin ein bestimmtes Iod-Atom entfernen und dadurch T4 in T3 umwandeln, aktivieren sie das Hormon. Die gleichen Enzyme übernehmen aber auch eine deaktivierende Funktion, indem sie aus T3 oder T4 ein anderes Iodatom herausnehmen. Auf diese Weise können die Dejodasen den gesamten Stoffwechsel sowohl beschleunigen als auch "abbremsen".
Erstmals entschlüsselt: Struktur und Mechanismus der Deiodasen
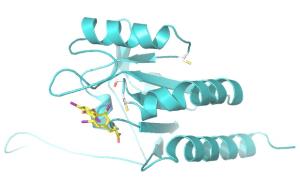
"Seit mehr als 30 Jahren haben Biochemiker und Endokrinologen herauszufinden versucht, wie die Deiodasen genau arbeiten. Doch erst mit den strukturbiologischen Analysen, die wir hier in Bayreuth durchgeführt haben, ist ein wegweisender Durchbruch gelungen", berichtet Prof. Dr. Clemens Steegborn, der an der Universität Bayreuth den Lehrstuhl für Biochemie leitet. Hier konnte die Struktur der Deiodase3 entschlüsselt werden. Gemeinsam mit Biochemikern des Universitätsklinikums Bonn und in Kooperation mit der Charité-Universitätsmedizin Berlin wurde dann aufbauend auf der Strukturinformation der Mechanismus des Enzyms aufgeklärt. Dabei stellte sich heraus, dass es Ähnlichkeiten zur Funktionsweise einer anderen Enzymfamilie gibt - nämlich der Peroxiredoxine, die schädliche Sauerstoffverbindungen abbauen helfen und an der Abwehr von oxidativem Stress beteiligt sind.
Deiodasen setzen zwar völlig andere Substanzen um, sind aber strukturell ähnlich zu Peroxiredoxinen und verwenden einen sehr ähnlichen Reaktionsmechanismus. Peroxiredoxine sind eine weit verbreitete und evolutionsbiologisch alte Enzymfamilie, aus der die Deiodasen offenbar hervorgegangen sind. Passend dazu haben die Forscher des Universitätsklinikums Bonn außerdem ein weiteres Rätsel gelöst: Sie haben gezeigt, dass Dejodasen durch kleine Redoxproteine wie Thioredoxin und Glutaredoxin wieder regeneriert werden.
Ansatzpunkte für neue Therapien
Die Erkenntnisse aus der Grundlagenforschung bergen auch Ansatzpunkte für neue Therapien. "Vor allem die Schilddrüsen-Überfunktion ist schwierig zu therapieren, wenn zum Beispiel Antikörper die Drüse zu exzessiver Hormonfreisetzung anregen", sagt Prof. Schweizer. Hier könnten mit entsprechenden Wirkstoffen die aktivierenden Deiodasen gebremst werden. "Die Struktur und der Mechanismus der Deiodasen können jetzt genutzt werden, um viel gezielter passende Hemmstoffe für Therapien zu entwickeln", ergänzt Prof. Steegborn.
Zusatzinformationen:
Ulrich Schweizer, Christine Schlicker, Doreen Braun, Josef Köhrle und Clemens Steegborn:
Crystal structure of mammalian selenocysteine-dependent iodothyronine deiodinase suggests a peroxiredoxin-like catalytic mechanism.
In: Proceedings of the National Academy of Sciences; PNAS, online veröffentlicht am 07. Juli 2014, DOI 10.1073/pnas.1323873111
Quelle: Rheinische Friedrich-Wilhelms-Universität, Bonn
Aktualisiert am 09.07.2014.
Permalink: https://www.internetchemie.info/news/2014/jul14/deiodase-struktur.php
© 1996 - 2026 Internetchemie ChemLin