Eine Peptid-Bindung ist eine kovalente chemische Bindung, die zwischen dem Carbonyl-Kohlenstoffatom der Carboxyl-Gruppe einer Aminosäure und dem Stickstoff-Atom der Amino-Gruppe einer weiteren Aminocarbonsäure unter Wasserabspaltung ausgebildet wird. Die resultierende funktionelle Gruppe ist ein Säureamid (im Formelbild gelb umrandet) und charakteristisches Merkmal der Stoffgruppe der Peptide und der Proteine. In der Regel wird der Begriff der Peptid-Bindung auf Strukturen aus α-Aminosäuren angewendet; grundsätzlich aber schließt er alle derartigen Bindungen unter Beteiligung einer beliebigen (auch nicht-alpha-ständigen) Aminosäure ein.
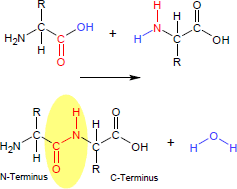
Das nun vorliegende Dipeptid besitzt eine weitere Amino- (N-Terminus) und eine weitere Carbonyl-Funktion (C-Terminus), die ihrerseits weitere Peptid-Bindungen zu anderen Aminosäuren ausbilden können. So können beliebig lange Ketten aneinander gereihter Aminosäuren gebildet werden. Peptide bestehen aus zwei bis etwa 100, Proteine aus mehr als 100 über die Peptidbindung verknüpfte Aminosäureeinheiten (Monomere).
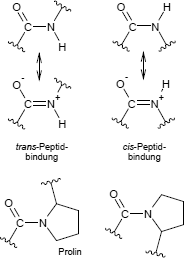
Geometrie und Mesomerie
Synthese
Die Verknüpfung der Aminosäuren über eine Peptid-Bindung ist chemisch gesehen eine so genannte Kondensationsreaktion unter Wasserabspaltung (Dehydratisierung), die Energie benötigt (endergon). In lebenden Organismen liefern ATP-Systeme die erforderliche Energie; die eigentliche Peptid- bzw. Protein-Synthese erfolgt hierbei unter Beteiligung spezifischer Enzyme bzw. Enzym-Systeme, die die Ausbildung der Peptid-Bindung durch Aktivierung der beteiligen reaktiven Gruppen katalysieren. So wird zum Beispiel das Tripeptid Glutathion in zwei Schritten aus den freien Aminosäuren durch die beiden Enzyme gamma-Gammaglutamylcysteinsynthetase und Glutathionsynthetase ermöglicht.
Die künstliche Synthese von Peptiden und Proteine erfolgt über verschiedene Ansätze der Flüssigphasenchemie bzw. der Festphasenchemie und unter Schutz der nicht an den Peptid-Bindungen beteiligen Aminosäure-Seitenketten mittels geeigneter Schutzgruppen.
Anwendungen
Peptide sind wichtige Biomoleküle, die in synthetischer Form zum Beispiel als Medikamente, Peptid-Antibiotika, Antikörper, in kosmetischen Präparaten, in der Forschung etc. Verwendung finden. Die Knüpfung von Peptid-Bindungen kann auf verschiedene Arten erfolgen; technisch verwendet man die so genannte Festphasensynthese (SPPS), ein Verfahren, dass auf der Merrifield Peptide Synthesis beruht. Diese Methode ermöglicht die schnelle Bildung von Peptid-Bindungen zwischen vorgegeben Sequenzen von Aminosäuren durch die aufeinanderfolgende Reaktion von speziellen Aminosäurederivaten an einem unlöslichen porösen Träger. Neben Forschungs- und Industrielaboratorien bieten mittlerweile auch viele Unternehmen Peptid-Synthesen im Auftrage von Kunden vor (Auftragssynthesen), die nicht über entsprechende Labor-Ausstattungen verfügen.
Quellen und Literaturhinweise
[1] - Gunter Fischer:
Chemical aspects of peptide bond isomerisation.
Chemical Society Reviews, (2000), DOI 10.1039/A803742F.
Kategorie: Funktionelle Gruppen
Letzte Änderung am 02. Juli 2023.
Permalink: https://www.internetchemie.info/chemie-lexikon/funktionelle-gruppen/p/peptid-bindung.php.
© 1996 - 2026 Internetchemie ChemLin