Kaliumhydrogencarbonat ist eine - häufig auch als Kaliumbicarbonat bezeichnete - anorganische Verbindung, die chemisch ein von der Kohlensäure abgeleitetes Kaliumsalz darstellt und aus Kalium-Kationen K+ und Hydrogencarbonat-Anionen HCO3- aufgebaut ist.
Bezeichnungen und Identifikatoren
Kaliumhydrogencarbonat
CHKO3
100,114 (g/mol)
298-14-6
206-059-0
TYJJADVDDVDEDZ-UHFFFAOYSA-M
Weitere Bezeichnungen, Synonyme
Kaliumbicarbonat; Monokaliumcarbonat; Kaliumsäurecarbonat
INCI-Bezeichnung
Potassium bicarbonate
Englische Bezeichnung
Potassium bicarbonate
Potassium hydrogen carbonate; Potassium acid carbonate
Handelsnamen; Präparate
Armicarb; Kaligreen
Chemische Formeln
Brutto- bzw. Summenformel und Strukturformel der chemischen Verbindung Kaliumhydrogencarbonat:
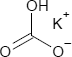
CHKO3
Mr = 100,1143 g/mol
SMILES: C(=O)(O)[O-].[K+]
Daten und Eigenschaften
Übersicht über die (bekannten) chemischen und physikalischen Eigenschaften: Kaliumhydrogencarbonat. Es gelten - soweit nicht anders angegeben - Raumumgebungsbedingungen (Normaldruck, 0 % Luftfeuchtigkeit, 20 °C).
In reinem Zustand liegt Kaliumhydrogencarbonat als geruchloses, leicht salzig und seifig schmeckendes, farbloses, leicht in Wasser lösliches, leicht alkalisch reagierendes, weißes, häufig verklumptes, kristallines Pulver oder als durchscheinende Kristalle vor. Die thermische Zersetzung des Bicarbonats setzt bei Temperaturen ab etwa 100 °C ein, wobei sich neben Kaliumcarbonat gasförmiges CO2 und Wasserdampf bilden:
2 KHCO3 → K2CO3 + CO2 + H2O.
+ Leicht löslich in Wasser (362 g/L bei 25 °C; siehe auch unten).
- Unlöslich in Alkohol.
(Z) 292 °C
2,17 g cm-3 bei 20 °C
pK1s = 6,35 bei 20 °C
Kaliumhydrogencarbonat-Lösung
Die nachfolgende Tabelle bildet einige Daten und Eigenschaften (Stoffmengenkonzentration c (Molarität), Massenkonzentration β, Dichte ρ, Brechnungsindex nD) von Kaliumhydrogencarbonat-Lösungen in Abhängigkeit vom Massenanteil an KHCO3 ab. Die Werte gelten jeweils für eine Temperatur von 20 °C.
| Massen- prozente | c [mol/L] | β [g/L] | Molalität b [mol/kg] | Dichte ρ [g cm-3] | Brechungsindex nD |
|---|---|---|---|---|---|
| 0,5 | 0,0500 | 5,01 | 0,050 | 1,0014 | 1,3335 |
| 1 | 0,1003 | 10,05 | 0,101 | 1,0046 | 1,3341 |
| 2 | 0,2020 | 20,23 | 0,204 | 1,0114 | 1,3353 |
| 3 | 0,3051 | 30,54 | 0,309 | 1,0181 | 1,3365 |
| 4 | 0,4094 | 40,99 | 0,416 | 1,0247 | 1,3376 |
| 5 | 0,5149 | 51,55 | 0,526 | 1,0310 | 1,3386 |
| 6 | 0,6220 | 62,27 | 0,638 | 1,0379 | 1,3397 |
| 7 | 0,7304 | 73,12 | 0,752 | 1,0446 | 1,3409 |
| 8 | 0,8402 | 84,11 | 0,869 | 1,0514 | 1,3419 |
| 9 | 0,9512 | 95,23 | 0,988 | 1,0581 | 1,3430 |
| 10 | 1,0638 | 106,50 | 1,110 | 1,0650 | 1,3441 |
| 11 | 1,1777 | 117,91 | 1,235 | 1,0719 | 1,3452 |
| 12 | 1,2931 | 129,46 | 1,362 | 1,0788 | 1,3462 |
| 13 | 1,4099 | 141,15 | 1,493 | 1,0858 | 1,3473 |
| 14 | 1,5283 | 153,01 | 1,626 | 1,0929 | 1,3484 |
| 15 | 1,6483 | 165,02 | 1,763 | 1,1001 | 1,3495 |
| 16 | 1,7697 | 177,17 | 1,903 | 1,1073 | 1,3506 |
| 17 | 1,8927 | 189,48 | 2,046 | 1,1146 | 1,3518 |
| 18 | 2,0175 | 201,98 | 2,193 | 1,1221 | 1,3528 |
| 19 | 2,1438 | 214,62 | 2,343 | 1,1296 | 1,3539 |
| 20 | 2,2718 | 227,44 | 2,497 | 1,1372 | 1,3550 |
| 21 | 2,4016 | 240,43 | 2,655 | 1,1449 | 1,3561 |
| 22 | 2,5331 | 253,59 | 2,817 | 1,1527 | 1,3572 |
| 23 | 2,6663 | 266,94 | 2,984 | 1,1606 | 1,3584 |
| 24 | 2,8012 | 280,44 | 3,154 | 1,1685 | 1,3595 |
| 25 | 2,9372 | 294,05 | 3,330 | 1,1762 | 1,3608 |
Spektroskopische Daten:
Berechnetes NMR-Spektrum (Predict Spectra via NMRDB)
1H NMR Spektrum, 13C NMR Spektrum.
Prozentuale und isotopische Zusammensetzung:
Massenbezogene elementare Zusammensetzung und Isotopen-Anteile der Verbindung Kaliumhydrogencarbonat - CHKO3 - berechnet auf Grundlage der Molekülmasse.
.Element E
der Atome Ex
und der Isotope *
der Isotope
Ex an Formelmasse
Kohlenstoff
12C: 12 u [98,94 %]
13C: 13,00335 u [1,06 %]
14C: 14,00324 u [<< 1 %]
12C: 11,87012 %
13C: 0,12717 %
14C: Spuren
Wasserstoff
1H: 1,00783 u [99,99 %]
2H: 2,0141 u [0,01 %]
3H: 3,01605 u [<< 1 %]
1H: 1,00675 %
2H: 0,0001 %
3H: Spuren
Kalium
39K: 38,96371 u [93,2581 %]
40K: 39,964 u [0,0117 %]
41K: 40,96183 u [6,7302 %]
39K: 36,4207 %
40K: 0,00457 %
41K: 2,62839 %
Sauerstoff
ΣAr = 47,997 u
16O: 15,99491 u [99,757 %]
17O: 16,99913 u [0,03835 %]
18O: 17,99916 u [0,205 %]
16O: 47,8257 %
17O: 0,01839 %
18O: 0,09828 %
*) Die dritte Spalte führt die Atommassen bzw. Isotopenmassen der beteligten Elemente sowie - in eckigen Klammern - die natürliche Isotopenzusammensetzung auf.
Weitere berechnete Daten
Die molare Masse ist M = 100,1143 Gramm pro Mol.
Die Stoffmenge von einem Kilogramm der Substanz ist n = 9,989 mol.
Die Stoffmenge von einem Gramm der Substanz ist n = 0,01 mol.
Monoisotopische Masse: 99,9562753742 Da - bezogen auf 12C1H39K16O3.
Synthese, Gewinnung
Die industrielle Produktion erfolgt durch das Einleiten von Kohlendioxid in eine wässrige Kaliumcarbonat-Lösung.
Verwendung
Als kostengünstige, ungiftige Base wird Kaliumhydrogencarbonat häufig in verschiedenen Anwendungen zur Regulierung des pH-Werts oder als Reagenz eingesetzt. Beispiele hierfür sind Puffermittel in Medikamenten oder auch als Zusatzstoff bei der Weinherstellung.
Der Stoff wird häufig dem Club-Soda zugesetzt, um den Geschmack zu verbessern und die Wirkung des Aufbrausens zu mildern. Außerdem findet das Bicarbonat Verwendung als Feuerunterdrückungsmittel in einigen Feuerlöschern mit Trockenmitteln. So ist es das einzige von der US National Fire Protection Association anerkannte Trockenlöschmittel zur Brandbekämpfung an Flughäfen und etwa doppelt so wirksam wie Natron (Natriumbicarbonat).
Wirkstoff Kaliumhydrogencarbonat
Lateinische Bezeichnung: Kalium Bicarbonicum.
ATC-Code:A12BA04
A12BA54
Kaliumhydrogencarbonat wird als Antazidum zur Regulierung der Magensäure sowie als Elektrolyt- und Kaliumzusatz verwendet. Es kann auch als Hilfsstoff in Arzneimittelformulierungen eingesetzt werden.
Detail-Informationen zum Wirkstoff in englischer Sprache: Siehe unter DrugBank DB11098 (Wirkstoff-Datenbank).
Verwendung in Lebensmitteln
E-Nummer: E501 II (gestrichen)
Kaliumhydrogencarbonat ist ein zugelassener Lebensmittel-Zusatzstoff, der verwendet wird, um den Säuregehalt oder die Basizität von Lebensmitteln zu regulieren oder auf andere Weise zu kontrollieren. Als Bestandteil von Backpulver setzt die Substanz beim Erwärmen Kohlendioxid-Gas frei, wodurch das Volumen des Teigs erhöht wird; der Teig geht dadurch auf und das Backgut wirkt leichter und weicher.
Eine früher unter der Bezeichnung Saleratus verwendete und 1840 eingeführte Substanz war ein kreideartiges Pulver, das als chemischer Sauerteig zur Erzeugung von Kohlendioxidgas im Teig verwendet wurde. Es war ein Vorläufer des Backpulvers und bestand im Wesentlichen aus Kalium- und Natriumhydrogencarbonat.
EU: Status und Vorschriften siehe EU Food Additives DB Ref.-Nummer 3362.
Verwendung in Kosmetika
INCI-Bezeichnung: Potassium bicarbonate
Als Puffersubstanz zugelassener Inhaltsstoff in Kosmetika und Körperpflegemitteln.
Quelle: CosIng (Cosmetic Ingredient Database der EU) Nummer: 36935.
Pestizid
Kaliumbicarbonat besitzt fungizide Eigenschaften und wird im ökologischen Landbau zur Bekämpfung von Mehltau und Apfelschorf eingesetzt.
Status der EU-Zulassung: Siehe EU Pestizid-Datenbank ID 51.
Externe Informationsquellen
Hersteller und Bezugsquellen
In der nachfolgenden Tabelle sind Produzenten und Lieferanten von Kaliumhydrogencarbonat als kommerzielle Chemikalie für Labor, Forschung, Industrie und Produktion mit den entsprechenden Kontaktdaten verzeichnet.
Literatur und Quellen
[0] - Fach- und Forschungsartikel in wissenschaftlichen Zeitschriften via PubMed: Potassium_bicarbonate.
Letzte Änderung am 08.03.2024.
Permalink: https://www.internetchemie.info/substanz/Kaliumhydrogencarbonat.php
© 1996 - 2026 Internetchemie ChemLin