Rubren ist eine organisch-chemische Verbindung aus der Gruppe der polycyclischen aromatischen Kohlenwasserstoffe.
Bezeichnungen und Identifikatoren
Rubren
C42H28
532,686 (g/mol)
517-51-1
208-242-0
YYMBJDOZVAITBP-UHFFFAOYSA-N
Systematischer Name
5,6,11,12-Tetraphenyltetracen
Weitere Bezeichnungen, Synonyme
5,6,11,12-Tetraphenylnaphthacen; Tetraphenylnaphthacen; Tetraphenyltetracen
Englische Bezeichnung
Rubrene
5,6,11,12-Tetraphenylnaphthacene
5,6,11,12-Tetraphenyltetracene
Chemische Formeln
Brutto- bzw. Summenformel und Strukturformel der chemischen Verbindung Rubren:
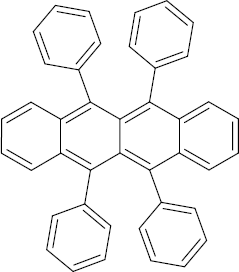
C42H28
Mr = 532,686 g/mol
5,6,11,12-Tetraphenyltetracen
SMILES: C1=CC=C(C=C1)C2=C3C=CC=CC3=C(C4=C(C5=CC=CC=C5C(=C24)C6=CC=CC=C6)C7=CC=CC=C7)C8=CC=CC=C8
Daten und Eigenschaften
Übersicht über die (bekannten) chemischen und physikalischen Eigenschaften: Rubren. Es gelten - soweit nicht anders angegeben - Raumumgebungsbedingungen (Normaldruck, 0 % Luftfeuchtigkeit, 20 °C).
Dunkelbraun-rötlicher, meist pulvriger Feststoff.
Rubren geht, wie andere polycyclische aromatische Moleküle auch, in Lösung Redoxreaktionen ein. Hiebei wird die Substanz reversibel bei 0,95 V bzw. -1,37 V gegenüber einer Kalomelelektrode oxidiert bzw. reduziert. Wenn das Kation und das Anion in einer elektrochemischen Zelle gemeinsam erzeugt werden, können sie sich unter Aufhebung ihrer Ladungen verbinden und erzeugen hierdurch ein angeregtes Rubrenmolekül, das Licht der Wellenlänge λ = 540 nm emittiert. Dieses Phänomen wird auch als Elektrochemilumineszenz bezeichnet.
315 °C
Raumgruppe Cmca, Nr. 64, Gitterparameter a = 2678,9 pm, b = 717,0 pm, c = 1421,1 pm; α = β = γ = 90 ° [1].
Es sind mehrere Polymorphe von Rubren bekannt. Aus Dampf im Vakuum gezüchtete Kristalle können monokline, trikline und orthorhombische Anordnungen aufweisen. Orthorhombische Kristalle werden in einem geschlossenen System in einem Zweizonenofen bei Umgebungsdruck erhalten.
Spektroskopische Daten:
Berechnetes NMR-Spektrum (Predict Spectra via NMRDB)
1H NMR Spektrum, 13C NMR Spektrum.
Prozentuale und isotopische Zusammensetzung:
Massenbezogene elementare Zusammensetzung und Isotopen-Anteile der Verbindung Rubren - C42H28 - berechnet auf Grundlage der Molekülmasse.
.Element E
der Atome Ex
und der Isotope *
der Isotope
Ex an Formelmasse
Kohlenstoff
ΣAr = 504,462 u
12C: 12 u [98,94 %]
13C: 13,00335 u [1,06 %]
14C: 14,00324 u [<< 1 %]
12C: 93,69773 %
13C: 1,00384 %
14C: Spuren
Wasserstoff
ΣAr = 28,224 u
1H: 1,00783 u [99,99 %]
2H: 2,0141 u [0,01 %]
3H: 3,01605 u [<< 1 %]
1H: 5,2979 %
2H: 0,00053 %
3H: Spuren
*) Die dritte Spalte führt die Atommassen bzw. Isotopenmassen der beteligten Elemente sowie - in eckigen Klammern - die natürliche Isotopenzusammensetzung auf.
Weitere berechnete Daten
Die molare Masse ist M = 532,686 Gramm pro Mol.
Die Stoffmenge von einem Kilogramm der Substanz ist n = 1,877 mol.
Die Stoffmenge von einem Gramm der Substanz ist n = 0,002 mol.
Monoisotopische Masse: 532,2191009016 Da - bezogen auf 12C421H28.
Synthese, Gewinnung
Rubren wird durch Behandeln von 1,1,3-Triphenylprop-2-in-1-ol - einem Addukt aus Phenylacetylen und Benzophenon - mit Thionylchlorid hergestellt.
Verwendung
Rubren ist eine chemolumineszente Gelblichtquelle und wird hierzu in Leuchtstäben eingesetzt. Als organischer Halbleiter findet Rubren Anwendung in organischen Leuchtdioden (OLEDs) und organischen Feldeffekttransistoren, die die Kernelemente moderner flexibler Displays sind. Einkristalltransistoren können unter Verwendung von kristallinem Rubren hergestellt werden, die in einem modifizierten Zonenofen gezüchtet werden. Rubren weist mit 40 cm2/(V s) die höchste Ladungsträgerbeweglichkeit für Defektelektronen unter den organischen Halbleitern auf.
Gefahren-Hinweise nach GHS
(Allgemeine Hinweise ohne Gewähr auf Richtigkeit und Vollständigkeit! Die Angaben ersetzen weder das Sicherheitsdatenblatt Chemikalien noch eine Gefährdungsbeurteilung, sondern geben eine allgemeine Übersicht hinsichtlich der Gefährdung durch den Gefahrstoff.)

Signalwort: Achtung
Gefahrenhinweise (H-Sätze):
- H315
Verursacht Hautreizungen. - H319
Verursacht schwere Augenreizung. - H335
Kann die Atemwege reizen.
Zur Kennzeichnung in der EU siehe ECHA Substance Infocard 100.007.494 sowie Informationen zu REACh unter ECHA Chem 100.007.494.
Externe Informationsquellen
Hersteller und Bezugsquellen
Rubren als kommerzielles Produkt von international tätigen Lieferanten und Suche nach Analoga siehe unter: ZINC000006920393.
In der nachfolgenden Tabelle sind Produzenten und Lieferanten von Rubren als kommerzielle Chemikalie für Labor, Forschung, Industrie und Produktion mit den entsprechenden Kontaktdaten verzeichnet.
Literatur und Quellen
[0] - Fach- und Forschungsartikel in wissenschaftlichen Zeitschriften via PubMed: Rubrene.
[1] - O. D. Jurchescu, A. Meetsma, T. T. M. Palstra:
Low-temperature structure of rubrene single crystals grown by vapor transport.
In: Acta Crystallographica Section B, (2006), DOI 10.1107/S0108768106003053.
Letzte Änderung am 20.04.2024.
Permalink: https://www.internetchemie.info/substanz/Rubren.php
© 1996 - 2026 Internetchemie ChemLin