Tetrachlorkohlenstoff ist eine organisch-chemische Verbindung aus der Gruppe der Chlorkohlenstoffe, die häufig auch als Tetrachlormethan bezeichnet wird. Das Molekül der Substanz leitet sich vom Methan ab, bei der alle vier H-Atome durch Chlor-Atome ersetzt sind.
In dem Kohlenstofftetrachlorid-Molekül sind die vier Chloratome symmetrisch an den Ecken eines Tetraeders positioniert und mit dem zentralen Kohlenstoff über kovalente Bindungen verbunden; auf Grund dieser symmetrischen Geometrie ist CCl4 unpolar. Die C-Cl-Bindungslänge beträgt 175 pm und der Cl-C-Cl-Winkel 109,5 °.
Bezeichnungen und Identifikatoren
Tetrachlorkohlenstoff
CCl4
153,811 (g/mol)
56-23-5
200-262-8
VZGDMQKNWNREIO-UHFFFAOYSA-N
Systematischer Name
Tetrachloromethan
Weitere Bezeichnungen, Synonyme
Methantetrachlorid; Kohlenstofftetrachlorid; Tetra; Tetrachlorkohlenwasserstoff
Englische Bezeichnung
Carbon tetrachloride
Tetrachloromethane; Benziform; Benzinoform; Carbon chloride; Methane tetrachloride
Handelsnamen; Präparate
R-10; Carbon tet; Halon-104; Refrigerant-10; Freon-10; Tetrasol; Tetraform; TCM
Chemische Formeln
Brutto- bzw. Summenformel und Strukturformel der chemischen Verbindung Tetrachlorkohlenstoff:
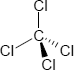
CCl4
Mr = 153,811 g/mol
Tetrachloromethan
SMILES: C(Cl)(Cl)(Cl)Cl
Daten und Eigenschaften
Übersicht über die (bekannten) chemischen und physikalischen Eigenschaften: Tetrachlorkohlenstoff. Es gelten - soweit nicht anders angegeben - Raumumgebungsbedingungen (Normaldruck, 0 % Luftfeuchtigkeit, 20 °C).
In reinem Zustand ist Tetrachlorkohlenstoff eine klare, farblose, lichtbrechende, leicht flüchtige, unangenehm süßlich riechende, giftige, auch bei höheren Temperaturen unter 982 °C nicht brennbare, wassunlösliche, stabile Flüssigkeit.
+ Mischbar mit Alkohol, Benzol, Chloroform, Ether, Petrolether, Ölen, Schwefelkohlenstoff.
- Praktisch unlöslich in Wasser (0,8461 mg/L; 0,06 Massenprozente, jeweils bei 20 °C).
- Verteilungskoeffizient logPOW = 2,83 bei 20 °C.
-22,92 °C
76,72 °C
982 °C
1,5940 g cm-3 bei 20 °C
12,046 kPa bei 19,9 °C
0,9578 mPa s bei 21 °C
0,901 mPa s bei 25 °C
0,7928 mPa s bei 35 °C
0,4056 mPa s bei 99 °C
28,0 dyn/cm bei 10 °C
26,8 dyn/cm bei 20 °C
22,2 dyn/cm bei 75 °C
nD = 1,4601 bei 20 °C
-139,3 kJ/mol bei 25 °C
0,21442 J/(mol K) bei 25 °C
-686 kJ/mol
10,88 kJ/(mol K)
0 D
εr = 2,2379 bei 20 °C
(Dielektrizitätskonstante)
Festes Tetrachlormethan weist zwei polymorphe Formen (Modifikationen) auf: Kristallines Tetrachlormethan II unterhalb von -47,5 °C und kristallines Tetrachlormethan I oberhalb von -47,5 °C mit einer monoklinen Kristallstruktur der Raumgruppe C2/c und den Gitterkonstanten a = 203, b = 116, und c = 199 nm, Winkel β = 111 °.
Spektroskopische Daten:
splash10-014i-3900000000-15e3b1fb84a75b2a20ee
Prozentuale und isotopische Zusammensetzung:
Massenbezogene elementare Zusammensetzung und Isotopen-Anteile der Verbindung Tetrachlorkohlenstoff - CCl4 - berechnet auf Grundlage der Molekülmasse.
.Element E
der Atome Ex
und der Isotope *
der Isotope
Ex an Formelmasse
Kohlenstoff
12C: 12 u [98,94 %]
13C: 13,00335 u [1,06 %]
14C: 14,00324 u [<< 1 %]
12C: 7,72616 %
13C: 0,08277 %
14C: Spuren
Chlor
ΣAr = 141,8 u
35Cl: 34,96885 u [75,80 %]
36Cl: 35,96831 u [<< 1 %]
37Cl: 36,9659 u [24,2 %]
35Cl: 69,88083 %
36Cl: Spuren
37Cl: 22,31024 %
*) Die dritte Spalte führt die Atommassen bzw. Isotopenmassen der beteligten Elemente sowie - in eckigen Klammern - die natürliche Isotopenzusammensetzung auf.
Weitere berechnete Daten
Die molare Masse ist M = 153,811 Gramm pro Mol.
Die Stoffmenge von einem Kilogramm der Substanz ist n = 6,501 mol.
Die Stoffmenge von einem Gramm der Substanz ist n = 0,007 mol.
Monoisotopische Masse: 151,87541076 Da - bezogen auf 12C35Cl4.
Synthese, Gewinnung
Tetrachlorkohlenstoff wurde erstmals 1839 von dem französischen Chemiker Henri Victor Regnault durch die Reaktion von Chloroform mit Chlor synthetisiert. Heute wird die in der Natur nicht auftretenden Chemikalie hauptsächlich aus Methan hergestellt:
CH4 + 4 Cl2 → CCl4 + 4 HCl.
Die Substanz fällt häufig auch als Nebenprodukt anderer Chlorierungsreaktionen an, beispielsweise bei den Synthesen von Dichlormethan und Chloroform. Höhere Chlorkohlenwasserstoffe werden auch einer Chlorolyse unterzogen:
C2Cl6 + Cl2 → 2 CCl4.
Vor den 1950er Jahren wurde Tetrachlorkohlenstoff durch Chlorierung von Schwefelkohlenstoff bei 105 bis 130 °C hergestellt:
CS2 + 3 Cl2 → CCl4 + S2Cl2.
Die Produktion von Tetrachlorkohlenstoff ist seit den 1980er Jahren aufgrund von Umweltbedenken und der verringerten Nachfrage nach FCKW, die aus Tetrachlorkohlenstoff gewonnen wurden, sehr stark zurückgegangen. Im Jahre1992 wurde die Produktion in den USA, Europa und Japan zusammen auf 720000 Tonnen geschätzt.
Verwendung
- Lösungsmittel für Öle und Fette.
- Früher viel eingesetztes Mittel in chemischen Reinigungen.
- Mittel für thermodynamische Wärmepumpen- oder Kältekreisläufe.
- Kältemittel in Klimaanlagen, Gefriergeräten und Kühlschränken.
- Früher als Begasungsmittel in der Landwirtschaft.
- Früher als Wirkstoff gegen Nematoden.
- Früher als Löschmittel in Feuerlöschern.
Eine Spezialanwendung gibt es für Briefmarkensammler in der Philatelie: Um ein Wasserzeichen auf einer Briefmarke zu erkennen und so deren Echtheit zu prüfen, ohne sie zu beschädigen, wurde eine kleine Menge Tetrachlorkohlenstoff auf die Rückseite gegeben und die Marke auf ein schwarzes Glas oder in eine Obsidianschale gegeben. Das Wasserzeichen - wenn vorhanden - wurde dadurch deutlich sichtbar.
Gefahren-Hinweise nach GHS
(Allgemeine Hinweise ohne Gewähr auf Richtigkeit und Vollständigkeit! Die Angaben ersetzen weder das Sicherheitsdatenblatt Chemikalien noch eine Gefährdungsbeurteilung, sondern geben eine allgemeine Übersicht hinsichtlich der Gefährdung durch den Gefahrstoff.)



Signalwort: Gefahr
Gefahrenhinweise (H-Sätze):
- H301
Giftig bei Verschlucken. - H311
Giftig bei Hautkontakt. - H331
Giftig bei Einatmen. - H351
Kann vermutlich Krebs erzeugen. - H372
Schädigt die Organe bei längerer oder wiederholter Exposition. - H412
Schädlich für Wasserorganismen, mit langfristiger Wirkung. - H420
Schädigt die öffentliche Gesundheit und die Umwelt durch Ozonabbau in der äußeren Atmosphäre.
Tetrachlorkohlenstoff steht im Verdacht krebserregend zu sein (C).
Zur Kennzeichnung in der EU siehe ECHA Substance Infocard 100.000.239 sowie Informationen zu REACh unter ECHA Chem 100.000.239.
Die WHO ordnet Tetrachlorkohlenstoff in die IARC-Gruppe 2B ein: Möglicherweise krebserzeugend für den Menschen! Siehe dort unter Monografie 20, Sup 7, 71, (1999).
Zur Toxikologie und zum Arbeitsschutz beim Umgang mit Tetrachlorkohlenstoff sowie Maßnahmen im Gefahrenfall siehe: Gefahrstoffinformationssystem GESTIS, ZVG-Nr. 001480.
Externe Informationsquellen
Hersteller und Bezugsquellen
In der nachfolgenden Tabelle sind Produzenten und Lieferanten von Tetrachlorkohlenstoff als kommerzielle Chemikalie für Labor, Forschung, Industrie und Produktion mit den entsprechenden Kontaktdaten verzeichnet.
Literatur und Quellen
[0] - Fach- und Forschungsartikel in wissenschaftlichen Zeitschriften via PubMed: Carbon_tetrachloride.
Letzte Änderung am 14.11.2024.
Permalink: https://www.internetchemie.info/substanz/Tetrachlorkohlenstoff.php
© 1996 - 2026 Internetchemie ChemLin