Arsensäure ist eine anorganisch-chemische Verbindung aus der Gruppe der mittelstarken dreiprotonigen Sauerstoffsäuren.
Die Salze der Arsensäure heißen Arsenate ([AsO4]3-), Hydrogenarsenate ([HAsO4]2-) bzw. Dihydrogenarsenate ([H2AsO4]-).
Bezeichnungen und Identifikatoren
Arsensäure
AsH3O4
H3AsO4
141,942 (g/mol)
7778-39-4
231-901-9
DJHGAFSJWGLOIV-UHFFFAOYSA-N
Weitere Bezeichnungen, Synonyme
Arsen(V)-säure
Englische Bezeichnung
Arsenic acid
Arsoric acid; Orthoarsenic acid
Handelsnamen; Präparate
Desiccant L-10; Zotox; Crab grass killer
Chemische Formeln
Brutto- bzw. Summenformel und Strukturformel der chemischen Verbindung Arsensäure:
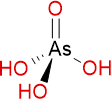
AsH3O4 oder H3AsO4
Mr = 141,9416 g/mol
SMILES: O[As](=O)(O)O
Daten und Eigenschaften
Übersicht über die (bekannten) chemischen und physikalischen Eigenschaften: Arsensäure. Es gelten - soweit nicht anders angegeben - Raumumgebungsbedingungen (Normaldruck, 0 % Luftfeuchtigkeit, 20 °C).
Arsensäure liegt alsdurchsichtig kristalliner bzw. als weißer, geruchloser, hygroskopischer Feststoff vor. Als reine wasserfreier Substanz ist die Substanz nicht isolierbar, sie existiert nur in wäßriger Lösung oder als Hemihydrat.
35,5 °C
160 °C
120 °C
2,5 g cm-3 bei 20 °C
pK1s = 2,26 bei 25 °C
pK2s = 6,76 bei 25 °C
pK3s = 11,29 bei 25 °C
18,45 hPa bei 25 °C
55 hPa bei 50 °C
Spektroskopische Daten:
Prozentuale und isotopische Zusammensetzung:
Massenbezogene elementare Zusammensetzung und Isotopen-Anteile der Verbindung Arsensäure - AsH3O4 - berechnet auf Grundlage der Molekülmasse.
.Element E
der Atome Ex
und der Isotope *
der Isotope
Ex an Formelmasse
Arsen
75As: 74,92159 u [100 %]
75As: 52,7834 %
Wasserstoff
ΣAr = 3,024 u
1H: 1,00783 u [99,99 %]
2H: 2,0141 u [0,01 %]
3H: 3,01605 u [<< 1 %]
1H: 2,13024 %
2H: 0,00021 %
3H: Spuren
Sauerstoff
ΣAr = 63,996 u
16O: 15,99491 u [99,757 %]
17O: 16,99913 u [0,03835 %]
18O: 17,99916 u [0,205 %]
16O: 44,97659 %
17O: 0,01729 %
18O: 0,09243 %
*) Die dritte Spalte führt die Atommassen bzw. Isotopenmassen der beteligten Elemente sowie - in eckigen Klammern - die natürliche Isotopenzusammensetzung auf.
Weitere berechnete Daten
Die molare Masse ist M = 141,941595 Gramm pro Mol.
Die Stoffmenge von einem Kilogramm der Substanz ist n = 7,045 mol.
Die Stoffmenge von einem Gramm der Substanz ist n = 0,007 mol.
Monoisotopische Masse: 141,9247281726 Da - bezogen auf 75As1H316O4.
Verwendung
Arsensäure wird (wurde) benutzt, um Gasblasen aus Keramikglasschmelzen zu entfernen (Klärmittel), und findet Verwendung bei der Herstellung von laminierten Leiterplatten. In geringerem Umfang wird der Stoff auch bei der Herstellung von Halbleitern und als Laborchemikalie verwendet.
Gefahren-Hinweise nach GHS
(Allgemeine Hinweise ohne Gewähr auf Richtigkeit und Vollständigkeit! Die Angaben ersetzen weder das Sicherheitsdatenblatt Chemikalien noch eine Gefährdungsbeurteilung, sondern geben eine allgemeine Übersicht hinsichtlich der Gefährdung durch den Gefahrstoff.)


Signalwort: Gefahr
Gefahrenhinweise (H-Sätze):
- H301
Giftig bei Verschlucken. - H314
Verursacht schwere Verätzungen der Haut und schwere Augenschäden. - H314
Verursacht schwere Verätzungen der Haut und schwere Augenschäden. - H318
Verursacht schwere Augenschäden. - H331
Giftig bei Einatmen. - H350
Kann Krebs erzeugen. - H361
Kann vermutlich die Fruchtbarkeit beeinträchtigen oder das Kind im Mutterleib schädigen. - H400
Sehr giftig für Wasserorganismen. - H410
Sehr giftig für Wasserorganismen, mit langfristiger Wirkung.
Besonders besorgniserregender Stoff (SVHC): Krebserregend (C).
LD50 (Ratte, oral): 48 mg/kg.
Zur Kennzeichnung in der EU siehe ECHA Substance Infocard 100.029.001 sowie Informationen zu REACh unter ECHA Chem 100.029.001.
Die WHO ordnet Arsensäure in die IARC-Gruppe 1 ein: Krebserzeugend für den Menschen! Siehe dort unter Monografie 23, Sup 7, 100C, (2012) [als Arsen-Verbindung].
Zur Toxikologie und zum Arbeitsschutz beim Umgang mit Arsensäure sowie Maßnahmen im Gefahrenfall siehe: Gefahrstoffinformationssystem GESTIS, ZVG-Nr. 500006.
Weitere unfangreiche toxikologische Daten und Gefahrstoff-Informationen liefert die Datenbank für gefährliche Stoffe (Hazardous Substances Data Bank) unter der Nummer HSDB 431.
Internationales Sicherheitsdatenblatt (SDS, MSDS) siehe ICSC: 1625 [englisch].
Beförderung gefährlicher Güter (Gefahrgut-Kennzeichnung): UN-Nummer 1553.
Externe Informationsquellen
Hersteller und Bezugsquellen
In der nachfolgenden Tabelle sind Produzenten und Lieferanten von Arsensäure als kommerzielle Chemikalie für Labor, Forschung, Industrie und Produktion mit den entsprechenden Kontaktdaten verzeichnet.
Literatur und Quellen
[0] - Fach- und Forschungsartikel in wissenschaftlichen Zeitschriften via PubMed: Arsenic+acid.
Letzte Änderung am 24.01.2024.
Permalink: https://www.internetchemie.info/substanz/Arsensäure.php
© 1996 - 2026 Internetchemie ChemLin