Nitromethan ist eine organisch-chemische Substanz aus der Gruppe der Nitroverbindungen. Im Detail handelt es sich um ein Nitroalkan, einer vom Methan durch Substition eines der H-Atom durch eine Nitro-Gruppe NO2 abgeleiteten Verbindung. Strukturell besitzt das freie gasförmige Molekül folgende Eigenschaften:
Bindungslängen: C-N 148,9 pm, N-O 122,4 pm, C-H 108,8 pm.
Bindungswinkel: ONO 125,3 °, NCH 107 °.
Bezeichnungen und Identifikatoren
Nitromethan
CH3NO2
61,04 (g/mol)
75-52-5
200-876-6
LYGJENNIWJXYER-UHFFFAOYSA-N
Weitere Bezeichnungen, Synonyme
Nitrocarbol
INCI-Bezeichnung
NITROMETHANE
Englische Bezeichnung
Nitromethane
Nitrocarbol; Nitro
Chemische Formeln
Brutto- bzw. Summenformel und Strukturformel der chemischen Verbindung Nitromethan:
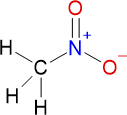
CH3NO2
Mr = 61,04 g/mol
SMILES: C[N+](=O)[O-]
Daten und Eigenschaften
Übersicht über die (bekannten) chemischen und physikalischen Eigenschaften: Nitromethan. Es gelten - soweit nicht anders angegeben - Raumumgebungsbedingungen (Normaldruck, 0 % Luftfeuchtigkeit, 20 °C).
Reines Nitromethan liegt unter Standardbedingungen als farblose, ölige Flüssigkeit vor, die einen schwachen, fruchtigen Eigengeruch aufweist.
+ Löslich in Wasser (105 g/L bei 20 °C). Mischbar mit Aceton, Diethylether, Alkoholen.
- Verteilungskoeffizient logPOW = -0,33 bei 25 °C.
-28,7 °C
101,2 °C
35 °C
418 °C
1,1390 g cm-3 bei 20 °C
1,1250 g cm-3 bei 30 °C
pK1s = 10,21 bei 25 °C
pK2s = 17,2 in DMSO
28 mmHg bei 20 °C
0,875 cP bei 0 °C
0,630 cP bei 25 °C
0,481 cP bei 50 °C
0,383 bei 75 °C
0,317 bei 100 °C
39,04 dyn/cm bei 10 °C
36,53 dyn/cm bei 25 °C
32,33 dyn/cm bei 50 °C
nD = 1,3817 bei 20 °C
-112,6 kJ/mol bei 25 °C [l]
-80,8 kJ/mol [g]
171,8 J/(mol K) bei 25 °C [l]
282,9 J/(mol K) [g]
-14,4 kJ/mol
33,99 kJ/mol bei 101,2 °C
38,27 kJ/mol bei 25 °C
9,703 kJ/mol bei -28,7 °C
-709,6 kJ/mol [l]
105,98 J/(mol K) bei 25 °C
11,3 MJ/kg
0,215 W/(m K) bei 0 °C
0,204 W/(m K) bei 25 °C
0,193 W/(m K) bei 50 °C
0,171 W/(m K) bei 100 °C
Tc = 315 °C
pc = 63,1 bar
ρc = 5,77 mol/L
3,46(2) D
11,08(7) eV
994 kJ/mol
ε = 37,27 bei 20 °C
(Dielektrizitätskonstante)
-21,0 × 10-6 cm3 mol-1
Spektroskopische Daten:
splash10-015c-9000000000-5d401a6fa80aa916b4e3
Berechnetes NMR-Spektrum (Predict Spectra via NMRDB)
1H NMR Spektrum, 13C NMR Spektrum.
Prozentuale und isotopische Zusammensetzung:
Massenbezogene elementare Zusammensetzung und Isotopen-Anteile der Verbindung Nitromethan - CH3NO2 - berechnet auf Grundlage der Molekülmasse.
.Element E
der Atome Ex
und der Isotope *
der Isotope
Ex an Formelmasse
Kohlenstoff
12C: 12 u [98,94 %]
13C: 13,00335 u [1,06 %]
14C: 14,00324 u [<< 1 %]
12C: 19,46868 %
13C: 0,20858 %
14C: Spuren
Wasserstoff
ΣAr = 3,024 u
1H: 1,00783 u [99,99 %]
2H: 2,0141 u [0,01 %]
3H: 3,01605 u [<< 1 %]
1H: 4,95363 %
2H: 0,0005 %
3H: Spuren
Stickstoff
14N: 14,00307 u [99,6205 %]
15N: 15,00011 u [0,3795 %]
14N: 22,86016 %
15N: 0,08708 %
Sauerstoff
ΣAr = 31,998 u
16O: 15,99491 u [99,757 %]
17O: 16,99913 u [0,03835 %]
18O: 17,99916 u [0,205 %]
16O: 52,29398 %
17O: 0,0201 %
18O: 0,10746 %
*) Die dritte Spalte führt die Atommassen bzw. Isotopenmassen der beteligten Elemente sowie - in eckigen Klammern - die natürliche Isotopenzusammensetzung auf.
Weitere berechnete Daten
Die molare Masse ist M = 61,04 Gramm pro Mol.
Die Stoffmenge von einem Kilogramm der Substanz ist n = 16,383 mol.
Die Stoffmenge von einem Gramm der Substanz ist n = 0,016 mol.
Monoisotopische Masse: 61,016378338851 Da - bezogen auf 12C1H314N16O2.
Verwendung
Nitromethan ist eine polare Flüssigkeit, die häufig als Lösungsmittel in einer Vielzahl industrieller Anwendungen wie Extraktionen, als Reaktionsmedium und als Reinigungslösungsmittel verwendet wird. Darüber hinaus ist die Chemikalie Zwischenprodukt bei vielen industriellen Synthesen und Kraftstoffzusatz in verschiedenen Motorsportarten.
Ein spezielles volldeuteriertes Isomer ist das Nitromethan-d3.
Wirkstoff Nitromethan
Detail-Informationen zum Wirkstoff in englischer Sprache: Siehe unter , NCI Thesaurus C44412 (Wirkstoff-Beschreibung).
Verwendung in Kosmetika
INCI-Bezeichnung: NITROMETHANE
In der EU zugelassener Inhaltsstoff kosmetischer Mittel in der Funktion als korrosionshemmende Komponente. Es gilt folgende Einschränkung: Die Höchstkonzentration in der gebrauchsfertigen Zubereitung darf 0,3 % nicht überschreiten.
Zu den Einschränkungen und Beschränkungen bei der Verwendung von Nitromethan in Kosmetika siehe Anhang III/18 der Verordnung (EG) Nr. 1223/2009 in der aktuellen Fassung.
Quelle: CosIng (Cosmetic Ingredient Database der EU) Nummer: 35508.
Gefahren-Hinweise nach GHS
(Allgemeine Hinweise ohne Gewähr auf Richtigkeit und Vollständigkeit! Die Angaben ersetzen weder das Sicherheitsdatenblatt Chemikalien noch eine Gefährdungsbeurteilung, sondern geben eine allgemeine Übersicht hinsichtlich der Gefährdung durch den Gefahrstoff.)



Signalwort: Achtung
Gefahrenhinweise (H-Sätze):
- H226
Flüssigkeit und Dampf entzündbar. - H302
Gesundheitsschädlich bei Verschlucken. - H332
Gesundheitsschädlich bei Einatmen. - H351
Kann vermutlich Krebs erzeugen. - H361d
Kann vermutlich das Kind im Mutterleib schädigen.
Nitromethan bildet entzündliche Dampf-Luftgemische mit einem Explosionsbereich zwischen 7,1 und 63 Vol.-% (Temperaturklasse T2; Explosionsklasse IIA).
LD50 (Ratte, oral): 940 mg/kg.
Zur Kennzeichnung in der EU siehe ECHA Substance Infocard 100.000.797 sowie Informationen zu REACh unter ECHA Chem 100.000.797.
Die WHO ordnet Nitromethan in die IARC-Gruppe 2B ein: Möglicherweise krebserzeugend für den Menschen! Siehe dort unter Monografie 77, (2000).
Zur Toxikologie und zum Arbeitsschutz beim Umgang mit Nitromethan sowie Maßnahmen im Gefahrenfall siehe: Gefahrstoffinformationssystem GESTIS, ZVG-Nr. 038500.
Weitere unfangreiche toxikologische Daten und Gefahrstoff-Informationen liefert die Datenbank für gefährliche Stoffe (Hazardous Substances Data Bank) unter der Nummer HSDB 106.
Internationales Sicherheitsdatenblatt (SDS, MSDS) siehe ICSC: 0522 [englisch].
Beförderung gefährlicher Güter (Gefahrgut-Kennzeichnung): UN-Nummer 1261.
Hinweis: Die Kennzeichnungspflicht gemäß CLP-Verordnung gilt unter anderem nicht für bestimmte Stoffe und Gemische für Endverbraucherinnen und Endverbraucher, die in Form von Fertigerzeugnissen vorliegen, wie zum Beispiel Arzneimittel, Tierarzneimittel, Kosmetika, bestimmte Medizinprodukte und medizinische Geräte, Lebensmittel oder Futtermittel sowie bestimmte Lebensmittelzusatzstoffe oder Aromastoffe. Hier sind gegebenenfalls gesonderte rechtliche Vorschriften einzuhalten.
Externe Informationsquellen
Hersteller und Bezugsquellen
In der nachfolgenden Tabelle sind Produzenten und Lieferanten von Nitromethan als kommerzielle Chemikalie für Labor, Forschung, Industrie und Produktion mit den entsprechenden Kontaktdaten verzeichnet.
Literatur und Quellen
[0] - Fach- und Forschungsartikel in wissenschaftlichen Zeitschriften via PubMed: Nitromethane.
Letzte Änderung am 28.09.2024.
Permalink: https://www.internetchemie.info/substanz/Nitromethan.php
© 1996 - 2026 Internetchemie ChemLin