Stickstoff - chemisches Zeichen N (von Nitrogenium), Ordnungszahl 7 - ist ein unter Normalbedingungen farbloses, geruchloses und geschmackloses gasförmiges chemisches Element der 5. Hauptgruppe des Periodensystems (Gruppe 15; Pentele).
Übersicht: Allgemeine Daten zum Stickstoff
Das Stickstoff-Atom
Das N-Atom - und damit das chemische Element Stickstoff - ist eindeutig durch die 7 positiv geladenen Protonen im Atomkern definiert. Für den elektrischen Ausgleich im ungeladenen Stickstoff-Atom sorgt die gleiche Anzahl an Elektronen.
Für Unterschiede bei den Atomkernen sorgen die Kernbausteine der Neutronen. Diese Atomsorten werden unter dem Begriff Stickstoff-Isotope bzw. Stickstoff-Nuklide zusammengefasst (Isotopen-Daten: siehe dort).
Die irdischen Stickstoff-Vorkommen bestehen aus einem Isotopengemisch vier verschiedener Nuklide; die relative Atommasse wird mit 14,007 u angegeben.
Elektronenkonfiguration
| Symbol | OZ | Kurzform | 1s | 2s | 2p |
| N | 7 | [He] 2s2 2p3 | 2 | 2 | 3 |
Ionisierungsenergien
Die folgende Tabelle listet die Bindungsenergien bzw. die Ionisierungsenergien IE des Stickstoff auf, also die erforderliche Energie in Elektronenvolt (eV), um ein bestimmtes Elektron von einem N-Atom zu trennen.
| 1. IE: | 14,5341 eV | 2. IE: | 29,6013 eV | 3. IE: | 47,44924 eV | 4. IE: | 77,4735 eV | 5. IE: | 97,8902 eV | 6. IE: | 552,0718 eV |
| 7. IE: | 667,046 eV | 8. IE: | eV | 9. IE: | eV | 10. IE: | eV | 11. IE: | eV | 12. IE: | eV |
Elektronenbindungsenergie
Die nachfolgende Tabelle listet die Elektronenbindungsenergien der einzelnen Stickstoff-Elektronen in den jeweiligen Orbitalen auf. Die Werte sind in Elektronenvolt (eV) angegeben.
| K | LI | LII | LIII |
| 1s | 2s | 2p1/2 | 2p3/2 |
| 409,9 | 37,3 |
Weitere Daten
65 pm (empirisch, nach Slater)
71 pm (in Einfach-Bindungen, nach Pyykkö et al.)
60 pm (in Zweifach-Bindungen, nach Pyykkö et al.)
54 pm (in Dreifach-Bindungen, nach Pyykkö et al.)
Spektrallinien des Stickstoffs
Die nachfolgende Abbildung zeigt ein Emissionsspektrum des Stickstoffs mit den charakteristischen Spektrallinien im sichtbaren Wellenlängenbereich zwischen 400 und 700 nm:

Chemische Daten
3,07 nach Allred-Rochow
3,066 nach Allen
2,9 nach Mulliken
2,93 nach Sanderson
7,4964 eV nach Gosh-Gupta
7,30 eV nach Pearson
Standardpotentiale
Normalpotential des Stickstoffs:
| E0 (V) | Nox | Name Ox. | Ox. | e- | ⇔ | Red. | Name Red. | Nox |
| -3,09 | 0 | Stickstoff | 3/2 N2 (g) + H+ | + e- | ⇔ | HN3 (g) | Stickstoffwasserstoffsäure | - III |
| -3,04 | 0 | Stickstoff | N2 (g) + 4 H2 | + 2 e- | ⇔ | 2 NH2OH + 2 OH- | Hydroxylamin | - I |
| 0,092 | 0 | Stickstoff | N2 (g) + 2 H2O (aq) | + 6 e- | ⇔ | 2 NH4OH (aq) | Ammoniumhydroxid | - III |
| 0,11 | - II | Hydrazin | + 2 e- | ⇔ | 2 NH4+ + 4 OH- | Ammonium-Ion | - III | |
| 0,8 | + V | Nitrat-Anion | NO3- (aq) + 2 H+ (aq) | + e- | ⇔ | NO2 (g) + H2O (aq) | Stickstoffdioxid | + IV |
| 1,42 | - I | Hydroxylammonium-Ion | 2NH3OH+ + H+ | + 2 e- | ⇔ | N2H5+ + 2 H2O | Hydrazinium-Ion | - II |
Material- und physikalische Eigenschaften des Stickstoffs
Die nachfolgende Übersicht führt einige physikalische Daten sowie Materialeigenschaften des reinen Stickstoff in Form von N2 auf.
1,040 J g-1 K-1 (spezifisch) (Distickstoff)
0,808 g cm-3 (flüssig, am Siedepunkt)
Externe Informationsangebote
Gruppenelemente - Informationen
Elemente der V. Hauptgruppe (Pnicogene, Pentele)
Vorlesungsskript: Anorganische Strukturchemie. Universität Freiburg
Pentele
Vorlesungsskript zur Anorganischen Chemie. Universität Rostock - Format: PDF
Pentele: Gruppe 15
Vorlesungsunterlagen: Chemie der Elemente. Universität Marburg - Format: PDF
Verbindungsklassen
N-Ringsysteme
Übersicht über die N-heterocyclischen Ringsysteme organischer Verbindungen
N-Sulfinylamine des Bors
Beiträge zur Chemie der Bor-Stickstoff-Verbindungen: Synthesen und Reaktionen von N-Sulfinylaminen des Bors. Dissertation, 2001. Universität Bochum
Stickstoff und Stickstoffverbindungen
Vorlesungsmaterialien: Anorganische Chemie. ETH Zürich - Format: PDF
Stickstoffoxide: Bildung, Strukturen, Eigenschaften, Bedeutung
Vortragsskript. Universität Bayreuth
Einzelne Verbindungen
Stickstoff und Stickstoffverbindungen
Chemikalien-Datenbank: physikalische und chemische Eigenschaften, Sicherheitsdatenblätter, kommerziell verfügbaren Stoffen und Verbindungen; verschiedene Suchkriterien einschließlich Struktursuche
Synthese, Herstellung, Produktion
Ammoniak-Synthese 10
... nach dem Haber-Bosch-Verfahren. Schematische Übersicht. Vorlesungmaterialien Technische Anorganische Chemie. Universität Freiburg - Format: PDF
Ammoniak-Synthese 2
... nach dem Haber-Bosch-Verfahren. Allgemeines zur Reaktionstechnik. Universität Freiburg - Format: PDF
Ammoniak-Synthese 3
... nach dem Haber-Bosch-Verfahren. Fließschema einer Ammoniak-Anlage. Universität Freiburg - Format: PDF
Analyse und Bestimmung
Stickstoffbestimmung
... nach Kjeldahl. Praktikumsskript - Format: PDF
Geochemie und Biogeochemie
Stickstoff - Zuviel des Guten?
Überlastung des Stickstoffkreislaufs zum Nutzen von Umwelt und Mensch wirksam reduzieren. Broschüre. Umweltbundesamt
Stickstoff Biogeochemie
Der biogeochemische Kreislauf des Stickstoffs - Format: PDF
Stickstoff-Fixierung
Stickstoff-Fixierung und Regulation der Photosynthese für die Stickstoff-Fixierung. Universität Konstanz - Format: PDF
Stickstofffixierung in Pflanzen
Vortragsskript. FH Münster - Format: PDF
Stickstofffixierung in Pflanzen
Vortragsskript Anorganische Chemie - Format: PDF
Stickstoffkreislauf
Grundlagen, grafische Übersicht. Universität Münster
Stickstoffkreislauf
... aus chemischer Sicht - Format: PDF
Newsarchiv
Wie schnell reagiert der chemische Zustand des Ozeans auf die Klimaerwärmung?
Milde Ammoniaksynthese
Chemiker überwinden wichtige Hürde: Reaktion eines Metallnitrids mit Wasserstoff zu Ammoniak unter sehr milden Reaktionsbedingungen
Stickstoff ist nicht so träge wie man denkt
Die neue Erkenntnis soll zu besseren Halbleitermaterialien führen ..
Sie sind meist nur wenige Millimeter bis Zentimeter lang und führen ein unscheinbares Leben am Gewässergrund. Doch tragen aquatische Insektenlarven und andere Kleinstlebewesen womöglich merklich zum Treibhauseffekt bei.
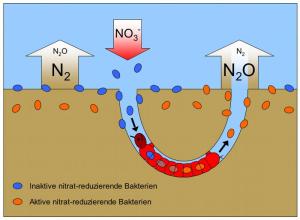
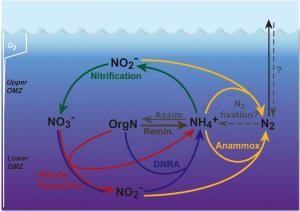
Vorhersagen über die Rolle des Ozeans für das Weltklima sind auf ein tiefgreifendes Verständnis der Stoffkreisläufe im Meer angewiesen. Bei den Stickstoffverlusten lag man bisher falsch. Eine neue Studie deckt nun die komplexen Zusammenhänge in der Sauerstoffminimumzone des tropischen Südostpazifiks auf.
Institute und Forschungseinrichtungen
NITROLIMIT
Forschungsprojekt: Stickstofflimitation in Binnengewässern
Kategorie: Chemische Elemente
Aktualisiert am 26.04.2020.
Permalink: https://www.internetchemie.info/chemische-elemente/stickstoff.php
© 1996 - 2026 Internetchemie ChemLin