Natriumacetat ist eine chemische Verbindung, die als Natriumsalz der Essigsäure charakterisiert wird und den systematischen Namen Natriumethanoat trägt. Strukturell handelt es sich um eine ionische Verbindung mit dem aus der Essigsäure stammenden, negativ geladenen Acetat-Anion, einem positiv geladenen Natrium-Kation als Gegenion. Neben dem hier beschriebenen wasserfreien Natriumsalz wird das Acetat häufig als Hydrat mit 3 Mol Kristallwasser eingesetzt; siehe: Natriumacetat Trihydrat sowie auch Natriumdiacetat.
Bezeichnungen und Identifikatoren
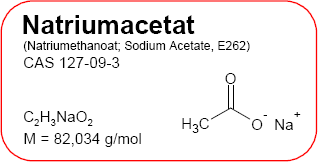
Natriumacetat
C2H3NaO2
CH3COONa
82,034 (g/mol)
127-09-3
204-823-8
VMHLLURERBWHNL-UHFFFAOYSA-M
Systematischer Name
Natriumethanoat
Weitere Bezeichnungen, Synonyme
Natriumacetat wasserfrei; Natriumazetat; Essigsäure Natriumsalz
INCI-Bezeichnung
SODIUM ACETATE
Englische Bezeichnung
Sodium acetate
Acetic acid sodium salt; Sodium ethanoate
Chemische Formeln
Brutto- bzw. Summenformel und Strukturformel der chemischen Verbindung Natriumacetat:
C2H3NaO2 oder CH3COONa
Mr = 82,0338 g/mol
Natriumethanoat
SMILES: CC(=O)[O-].[Na+]
Daten und Eigenschaften
Übersicht über die (bekannten) chemischen und physikalischen Eigenschaften: Natriumacetat. Es gelten - soweit nicht anders angegeben - Raumumgebungsbedingungen (Normaldruck, 0 % Luftfeuchtigkeit, 20 °C).
Wasserfreies Natriumacetat ist in reiner Form und unter Standardbedingungen ein weißes bzw. farbloses, hygroskopisches, kristallines Pulver, das einen schwachen Geruch nach Essigsäure aufweisen kann. Die Substanz ist brennbar, aber schwer entzündbar.
324 °C
881,4 °C
1,528 g cm-3 bei 20 °C
-709,32 kJ/mol bei 25 °C
138,1 J/(mol K) bei 25 °C
-607,7 kJ/mol
100,83 J/(mol K)
Spektroskopische Daten:
Berechnetes NMR-Spektrum (Predict Spectra via NMRDB)
1H NMR Spektrum, 13C NMR Spektrum.
Prozentuale und isotopische Zusammensetzung:
Massenbezogene elementare Zusammensetzung und Isotopen-Anteile der Verbindung Natriumacetat - C2H3NaO2 - berechnet auf Grundlage der Molekülmasse.
.Element E
der Atome Ex
und der Isotope *
der Isotope
Ex an Formelmasse
Kohlenstoff
ΣAr = 24,022 u
12C: 12 u [98,94 %]
13C: 13,00335 u [1,06 %]
14C: 14,00324 u [<< 1 %]
12C: 28,97266 %
13C: 0,3104 %
14C: Spuren
Wasserstoff
ΣAr = 3,024 u
1H: 1,00783 u [99,99 %]
2H: 2,0141 u [0,01 %]
3H: 3,01605 u [<< 1 %]
1H: 3,68592 %
2H: 0,00037 %
3H: Spuren
Natrium
22Na: 21,99444 u [<< 1 %]
23Na: 22,98977 u [100 %]
24Na: 23,99096 u [<< 1 %]
22Na: Spuren
23Na: 28,02476 %
24Na: Spuren
Sauerstoff
ΣAr = 31,998 u
16O: 15,99491 u [99,757 %]
17O: 16,99913 u [0,03835 %]
18O: 17,99916 u [0,205 %]
16O: 38,9111 %
17O: 0,01496 %
18O: 0,07996 %
*) Die dritte Spalte führt die Atommassen bzw. Isotopenmassen der beteligten Elemente sowie - in eckigen Klammern - die natürliche Isotopenzusammensetzung auf.
Weitere berechnete Daten
Die molare Masse ist M = 82,03376928 Gramm pro Mol.
Die Stoffmenge von einem Kilogramm der Substanz ist n = 12,19 mol.
Die Stoffmenge von einem Gramm der Substanz ist n = 0,012 mol.
Monoisotopische Masse: 82,0030736146 Da - bezogen auf 12C21H323Na16O2.
Synthese, Gewinnung
Natriumacetat kann durch die Umsetzung verschiedener Natriumsalze wie Natriumhydroxid, Natriumcarbonat, Natron sowie metallischem Natrium (stark exotherme Reaktion) mit Essigsäure erhalten werden.
Wirkstoff Natriumacetat
ATC-Code:B05XA08
Das Natrium-Ion Na+ ist das Hauptkation der extrazellulären Flüssigkeit und spielt eine große Rolle bei Flüssigkeits- und Elektrolytersatztherapien. Wasserfreies Natriumacetat wird als Elektrolyt-Regenerator in isosmotischen Lösungen zum parenteralen Ersatz akuter Verluste an extrazellulärer Flüssigkeit verwendet, ohne den normalen Elektrolythaushalt zu stören.
Detail-Informationen zum Wirkstoff in englischer Sprache: Siehe unter DrugBank DB09395 (Wirkstoff-Datenbank), NCI Thesaurus C48017 (Wirkstoff-Beschreibung).
Verwendung in Lebensmitteln
E-Nummer: E262
Die Salze der Essigsäure, zu denen auch das Natriumacetat zählt, sind under der E-Nummer E 262 zugelassene Lebensmittelzusatzstoffe und werden vor allem als Säureregulatoren eingesetzt, d. h. sie mildern einen allzu starken sauren Geschmack. Darüber hinaus wirken die Acetate als Konservierungsmittel. Eine Mengenbegrenzung in Lebensmitteln gibt es nicht.
Verwendung in Kosmetika
INCI-Bezeichnung: SODIUM ACETATE
Natriumacetat ist als puffernder (pH-regulierender) und geruchsmaskierender Inhaltsstoff in kosmetischen Produkten zugelassen.
Quelle: CosIng (Cosmetic Ingredient Database der EU) Nummer: 37720.
Externe Informationsquellen
Hersteller und Bezugsquellen
In der nachfolgenden Tabelle sind Produzenten und Lieferanten von Natriumacetat als kommerzielle Chemikalie für Labor, Forschung, Industrie und Produktion mit den entsprechenden Kontaktdaten verzeichnet.
Literatur und Quellen
[0] - Fach- und Forschungsartikel in wissenschaftlichen Zeitschriften via PubMed: Sodium_acetate.
Letzte Änderung am 20.04.2024.
Permalink: https://www.internetchemie.info/substanz/Natriumacetat.php
© 1996 - 2026 Internetchemie ChemLin