Die Salicylsäure ist eine organisch-chemische Verbindung aus der Gruppe der Phenolsäuren bzw. der Hydroxybenzoesäuren.
Die Ester und Salze der Salicylsäure heißen Salicylate.
Bezeichnungen und Identifikatoren
Salicylsäure
C7H6O3
138,122 (g/mol)
69-72-7
200-712-3
YGSDEFSMJLZEOE-UHFFFAOYSA-N
Systematischer Name
2-Hydroxybenzencarbonsäure
Weitere Bezeichnungen, Synonyme
2-Hydroxybenzoesäure; ortho-Hydroxybenzoesäure; o-Hydroxybenzoesäure; Spirsäure; Spiroylsäure; Acidum salicylicum; Salizylsäure
INCI-Bezeichnung
Salicylic Acid
Englische Bezeichnung
Salicylic acid
2-Hydroxybenzoic acid
Chemische Formeln
Brutto- bzw. Summenformel und Strukturformel der chemischen Verbindung Salicylsäure:
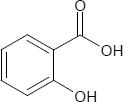
C7H6O3
Mr = 138,122 g/mol
2-Hydroxybenzencarbonsäure
SMILES: c1ccc(c(c1)C(=O)O)O
Daten und Eigenschaften
Übersicht über die (bekannten) chemischen und physikalischen Eigenschaften: Salicylsäure. Es gelten - soweit nicht anders angegeben - Raumumgebungsbedingungen (Normaldruck, 0 % Luftfeuchtigkeit, 20 °C).
Salicylsäure liegt in reinem Zustand als farblose und geruchlose Substanz vor, die einen eigentümlichen, süß-säuerlichen Geschmack aufweist.
+ Salicylsäure ist mit etwa 2 Gramm pro Liter bei 20 °C schlecht in Wasser löslich; weitere Werte für Wasser: 1,24 g/L (0°C), 2,48 g/L (25°C), 4,14 g/L (40°C), 17,41 g/L (75 °C) und 77,79 g/L (100 °C).
Löslichkeit in anderen Lösungsmitteln: Benzol 7,75 g/L (25°C), Chloroform 22,2 g/l (25°C), Methanol 624,8 g/L (21°C), Olivenöl 243 g/L (23°C), Aceton 396 g/L (23°C).
- Verteilungskoeffizient logPOW = 2,64 bei 20 °C.
158,6 °C
> 200 °C
157 °C
540 °C
76 °C
1,443 g cm-3 bei 20 °C
pK1s = 2,97 (-COOH bei 25°C)
pK2s = 13,82 (-OH bei 20 °C)
-589,9 kJ/mol bei 25 °C [s]
-3,025 MJ/mol [s]
2,65 D
-73,23 × 10-6 cm3 mol-1
Spektroskopische Daten:
splash10-0006-9100000000-763c645b0d88993034f3
Berechnetes NMR-Spektrum (Predict Spectra via NMRDB)
1H NMR Spektrum, 13C NMR Spektrum.
Prozentuale und isotopische Zusammensetzung:
Massenbezogene elementare Zusammensetzung und Isotopen-Anteile der Verbindung Salicylsäure - C7H6O3 - berechnet auf Grundlage der Molekülmasse.
.Element E
der Atome Ex
und der Isotope *
der Isotope
Ex an Formelmasse
Kohlenstoff
ΣAr = 84,077 u
12C: 12 u [98,94 %]
13C: 13,00335 u [1,06 %]
14C: 14,00324 u [<< 1 %]
12C: 60,22631 %
13C: 0,64524 %
14C: Spuren
Wasserstoff
ΣAr = 6,048 u
1H: 1,00783 u [99,99 %]
2H: 2,0141 u [0,01 %]
3H: 3,01605 u [<< 1 %]
1H: 4,3783 %
2H: 0,00044 %
3H: Spuren
Sauerstoff
ΣAr = 47,997 u
16O: 15,99491 u [99,757 %]
17O: 16,99913 u [0,03835 %]
18O: 17,99916 u [0,205 %]
16O: 34,66527 %
17O: 0,01333 %
18O: 0,07124 %
*) Die dritte Spalte führt die Atommassen bzw. Isotopenmassen der beteligten Elemente sowie - in eckigen Klammern - die natürliche Isotopenzusammensetzung auf.
Weitere berechnete Daten
Die molare Masse ist M = 138,122 Gramm pro Mol.
Die Stoffmenge von einem Kilogramm der Substanz ist n = 7,24 mol.
Die Stoffmenge von einem Gramm der Substanz ist n = 0,007 mol.
Monoisotopische Masse: 138,0316940502 Da - bezogen auf 12C71H616O3.
Vorkommen
Der Name der Salicylsäure leitet sich vom botanischen Namen der Weiden (Salix alba = Weiße Weide) ab, aus deren Rindenextrakt die Substanz erstmals 1828 vom deutschen Chemiker Johann Andreas Buchner isoliert wurde. Andere Forscher isolierten die Säure aus Mädesüß (Filipendula, auch Spierstaude; lat. Spirea) und nannten sie Spirsäure.
Insgesamt ist Salicylsäure als freie Substanz, vor allem aber in Form von Estern (Salicylate) und Derivaten im Pflanzenreich weit verbreitet. Als pflanzliches Phytohormon ist es unter anderem an Pflanzenwachtum und -entwicklung, an der Fotosynthese, an der Transpiration sowie der Ionen-Aufnahme und dem Ionen-Transport beteiligt. Darüber hinaus ist Salicylsäure an Resistenz-Mechanismen gegen Krankheitserreger und Schädlingsbefall beteiligt.
Synthese, Gewinnung
Die technische Synthese von Salicylsäure erfolgt ausschließlich chemisch, ausgehend von Phenol bzw. Natriumphenolat, das mit Kohlendioxid bei hohem Druck (100 atm) und hoher Temperatur in einer so genannten Kolbe-Schmitt-Reaktion umgesetzt wird. Bei dieser Reaktion entsteht zunächst Natriumsalicylat; die freie Säure erhält man durch Ansäuern zum Beispiel mit Schwefelsäure.
Verwendung
In der Industrie ist Salicylsäure ein Ausgangsstoff für eine Reihe von Produkten und Verbindungen wie zum Beispiel Farb- und Duftstoffe sowie für Acetylsalicylsäure (ASS, Aspirin).
Wirkstoff Salicylsäure
ATC-Code:D01AE12
D01AE62
D02AF01
D10AX11
D11AF01
D05AX56
D10AX61
D11AF51
S01BC08
Antimykotika zur topischen Anwendung; Emollentium und Hautschutzmittel; Aknemittel; Nichtsteroidales Antiphlogistikum. Salicylsäure ist das am häufigsten verwendete Mittel, um die äußere Schicht der Haut zu entfernen (Keratolytikum). In dieser Funktion findet man sie in Zubereitungen zur Behandlung von Warzen, Psoriasis, Akne, Ichthyose und anderen.
Detail-Informationen zum Wirkstoff in englischer Sprache: Siehe unter DrugBank DB00936 (Wirkstoff-Datenbank).
Verwendung in Kosmetika
INCI-Bezeichnung: Salicylic Acid
Salicylsäure ist in der EU ein zugelassener Inhaltsstoff kosmetischer Mittel in der Funktion als Anti-Schuppenmittel, zur Haarkonditionierung, als Keratolytikum (zum Abschälen der Haut zur Entfernung von Hornschichten und Schuppen), als Mittel zur Geruchsmaskierung und zur Hautpflege und auch als Konservierungsstoff.
In der EU unterliegt der Einsatz von Salicylsäure in kosmetischen Produkten verschiedenen Auflagen:
Es gilt eine Höchstkonzentration in der gebrauchsfertigen Zubereitung von 3,0 Prozent für Haarmittel, die ausgespült werden bzw. von 2,0 % bei sonstigen Produkten. In Körperlotionen, Lidschatten, Wimperntuschen, Eyeliner, Lippenstifte und Rollstiftdeodorante darf die Höchstkonzentration an Salicylsäure 0,5 % nicht überschreiten.
Nicht in Mitteln für Kinder unter 3 Jahren verwenden. Nicht zur Verwendung in Anwendungen, die durch Inhalation zur Exposition der Lunge der Endverbraucher führen können. Nicht in Mundmitteln verwenden. Für einen anderen Zweck als die Hemmung der Vermehrung von Mikroorganismen im Erzeugnis. Dieser Zweck muss aus der Aufmachung des Erzeugnisses ersichtlich sein. Diese Werte beinhalten eine etwaige Verwendung von Salicylsäure.
Die salicylsäurehaltigen Produkte müssen folgenden Warnhinweis tragen: Nicht für Kinder unter 3 Jahren verwenden (Nur bei Mitteln, die gegebenenfalls für Kinder unter 3 Jahren verwendet werden könnten)!
[vgl. EU Verordnung (EG) Nr. 1223/2009, Anhang III, Nr. 98 und Anhang V Nr. 3].
Zu den Einschränkungen und Beschränkungen bei der Verwendung von Salicylsäure in Kosmetika siehe Anhang III/98; V/3 der Verordnung (EG) Nr. 1223/2009 in der aktuellen Fassung.
Quelle: CosIng (Cosmetic Ingredient Database der EU) Nummer: 37595.
Duftstoff, Aromastoff
Aromastoff in Lebensmitteln.
Salicylsäure ist als Aromastoff und/oder Duftstoff in den einschlägigen Listen aufgeführt (siehe folgende Identifikatoren).
EU-Vorschriften: Siehe Datenbank für Lebensmittelaromen Ref.-Nr. 4324 (EU Food Flavourings Database)
08.112
958
Gefahren-Hinweise nach GHS
(Allgemeine Hinweise ohne Gewähr auf Richtigkeit und Vollständigkeit! Die Angaben ersetzen weder das Sicherheitsdatenblatt Chemikalien noch eine Gefährdungsbeurteilung, sondern geben eine allgemeine Übersicht hinsichtlich der Gefährdung durch den Gefahrstoff.)



Signalwort: Gefahr
Gefahrenhinweise (H-Sätze):
- H302
Gesundheitsschädlich bei Verschlucken. - H318
Verursacht schwere Augenschäden. - H361d
Kann vermutlich das Kind im Mutterleib schädigen.
Salicylsäure steht im Verdacht, fortpflanzungsgefährdend zu sein (R) und wird als endokrin wirksam eingestuft.
Zur Kennzeichnung in der EU siehe ECHA Substance Infocard 100.000.648 sowie Informationen zu REACh unter ECHA Chem 100.000.648.
Zur Toxikologie und zum Arbeitsschutz beim Umgang mit Salicylsäure sowie Maßnahmen im Gefahrenfall siehe: Gefahrstoffinformationssystem GESTIS, ZVG-Nr. 017840.
Hinweis: Die Kennzeichnungspflicht gemäß CLP-Verordnung gilt unter anderem nicht für bestimmte Stoffe und Gemische für Endverbraucherinnen und Endverbraucher, die in Form von Fertigerzeugnissen vorliegen, wie zum Beispiel Arzneimittel, Tierarzneimittel, Kosmetika, bestimmte Medizinprodukte und medizinische Geräte, Lebensmittel oder Futtermittel sowie bestimmte Lebensmittelzusatzstoffe oder Aromastoffe. Hier sind gegebenenfalls gesonderte rechtliche Vorschriften einzuhalten.
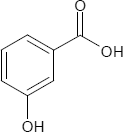
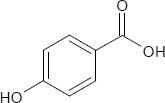
Hydroxybenzoesäuren
Salicylsäure ist die ortho-Hydroxybenzoesäure. Es existieren zwei weitere Hydroxybenzoesäuren, die sich in der Stellung der Substituenten am Benzolring unterscheiden; diese sind:
Externe Informationsquellen
Hersteller und Bezugsquellen
In der nachfolgenden Tabelle sind Produzenten und Lieferanten von Salicylsäure als kommerzielle Chemikalie für Labor, Forschung, Industrie und Produktion mit den entsprechenden Kontaktdaten verzeichnet.
Literatur und Quellen
[1] - Raman K. Madan, Jacob Levitt:
A review of toxicity from topical salicylic acid preparations.
In: Journal of the American Academy of Dermatology, (2014), DOI 10.1016/j.jaad.2013.12.005.
[2] - NN:
Opinion on salicylic acid (CAS 69-72-7).
In: EU publications, (2019), DOI 10.2875/081047.
Letzte Änderung am 22.04.2024.
Permalink: https://www.internetchemie.info/substanz/Salicylsäure.php
© 1996 - 2026 Internetchemie ChemLin