
Caesium ist das Himmelblaue unter den chemischen Elementen - seinen Namen erhielt es von den Entdeckern Gustav Robert Kirchhoff und Robert Wilhelm Bunsen im Jahre 1861 wegen seiner blauen Spektrallinien, abgeleitet vom lateinischen Begriff caesius für das Himmelsblau.
Das Caesium befindet sich im Periodensystem in der ersten Gruppe und ist damit ein Hautgruppenelement und den Alkalimetallen zugeordnet. In reinem Zustand zeigt es sich als wachsweiches, mit dem Messer schneidbares Leichtmetall, das an den frischen Schnittstellen silbrig oder - auf Grund von Verunreinigungen durch andere Metalle - goldgelb glänzt und das in kubisch-raumzentriertem Gitter kristallisiert.
Cäsium zählt zu den Pyrophoren: An der Luft reagiert das frisch angeschnittene Metall heftig unter Verbrennungserscheinunungen mit dem Luft-Sauerstoff unter Bildung von Caesiumhyperoxid gemäß der Reaktionsgleichung
Cs + O2 → CsO2.
Ebenso heftig ist die Reaktion mit Wasser und selbst Wassereis (bis zu - 116 Grad Celsius), bei der neben Caesiumhydroxid Wasserstoff entsteht und sich entzündet:
2 Cs + 2 H2O → 2 CsOH + H2
Übersicht: Allgemeine Daten zum Caesium
Das Caesium-Atom
Das Cs-Atom - und damit das chemische Element Cäsium - ist eindeutig durch die 55 positiv geladenen Protonen im Atomkern definiert. Für den elektrischen Ausgleich im ungeladenen Cäsium-Atom sorgt die gleiche Anzahl an Elektronen.
Für Unterschiede bei den Atomkernen sorgen die Kernbausteine der Neutronen. Diese Atomsorten werden unter dem Begriff Cäsium-Isotope zusammengefasst (Isotopen-Daten: siehe dort).
Die irdischen Cäsium-Vorkommen bestehen nur einem Cäsium-Nuklid; es besitzt die Massenzahl 133. Die relative Atommasse des Cäsiums wird mit 132,90545196(6)u angegeben.
Elektronenkonfiguration
| Symbol | OZ | Kurzform | 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f | 5s | 5p | 5d | 5f | 6s | 6p | 6d | 6f |
| Cs | 55 | [Xe] 6s1 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 2 | 6 | 1 |
Ionisierungsenergien
| 1. IE: | 3,893905 eV | 2. IE: | 23,15744 eV | 3. IE: | eV | 4. IE: | eV | 5. IE: | eV | 6. IE: | eV |
Elektronenbindungsenergie
Die nachfolgende Tabelle listet die Elektronenbindungsenergien der einzelnen Caesium-Elektronen in den jeweiligen Orbitalen auf. Die Werte sind in Elektronenvolt (eV) angegeben.
| K | LI | LII | LIII |
| 1s | 2s | 2p1/2 | 2p3/2 |
| 35985 | 5714 | 5359 | 5012 |
| MI | MII | MIII | MIV | MV |
| 3s | 3p1/2 | 3p3/2 | 3d3/2 | 3d5/2 |
| 1211 | 1071 | 1003 | 740,5 | 726,6 |
| NI | NII | NIII | NIV | NV | NVI | NVII |
| 4s | 4p1/2 | 4p3/2 | 4d3/2 | 4d5/2 | 4f5/2 | 4f7/2 |
| 232,3 | 172,4 | 161,3 | 79,8 | 77,5 | - | - |
| OI | OII | OIII | OIV | OV |
| 5s | 5p1/2 | 5p3/2 | 5d3/2 | 5d5/2 |
| 22,7 | 14,2 | 12,1 |
Weitere Daten
260 pm (empirisch, nach Slater)
232 pm (in Einfach-Bindungen, nach Pyykkö et al.)
209 pm (in Zweifach-Bindungen, nach Pyykkö et al.)
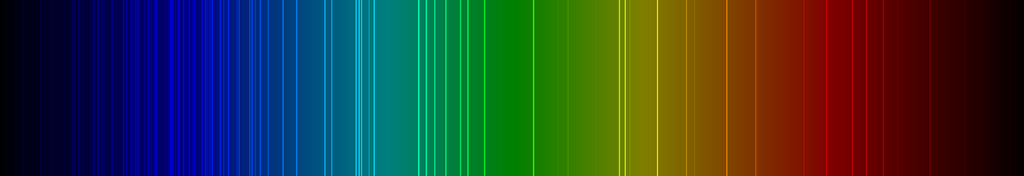
Spektrallinien des Caesiums
Die nachfolgende Abbildung zeigt ein Emissionsspektrum des Cäsiums mit den charakteristischen Spektrallinien im sichtbaren Wellenlängenbereich zwischen 400 und 700 nm:
Chemie des Caesiums
Als Element der ersten Hauptgruppe ist die Chemie des Cäsiums geprägt von dem einen Valenzelelektron, das sich in der 6s-Schale aufhält und bereitwillig an elektronegativere Bindungspartner abgegeben wird.
Chemische Daten
0,86 nach Allred-Rochow
0,659 nach Allen
1,0 nach Mulliken
0,69 nach Sanderson
2,18 eV nach Pearson
Standardpotentiale
Normalpotential des Caesiums:
| E0 (V) | Nox | Name Ox. | Ox. | e- | ⇔ | Red. | Name Red. | Nox |
| -3,026 | + I | Cäsium-Kation | Cs+ | + e- | ⇔ | Cs | Cäsium | 0 |
Material- und physikalische Eigenschaften des Caesiums
Die nachfolgende Tabelle führt einige physikalische Daten sowie Materialeigenschaften des reinen Cäsiums auf.
0,242 J g-1 K-1 (spezifisch)
nach Brinell: 0,00014 GPa
Geochemie, Vorkommen, Verteilung
Die nachfolgende Tabelle führt die Cäsium-Verteilung in verschiedenen geologischen Medien auf.
Gefahren und Sicherheit


Gefahr
(Allgemeine Hinweise ohne Gewähr auf Richtigkeit und Vollständigkeit)
Cäsiummetall ist eines der reaktivsten Elemente und in Gegenwart von Wasser hochexplosiv. Das durch die Reaktion erzeugte Wasserstoff-Gas wird durch die gleichzeitig freigesetzte Wärmeenergie erhitzt, was zu einer Entzündung und einer heftigen Explosion führt. Im Gegensatz zu den anderen Alkalimetallen ist die Reaktion des Cäsiums ist so stark, dass diese explosive Reaktion auch durch kaltes Wasser ausgelöst werden kann.
Brennendes Caesium wird mit Metallbrandlöschern oder mit trockenem Sand gelöscht.
Gefahren-Hinweise (H-Sätze):
H260 - Bei Berührung mit Wasser entstehen entzündbare Gase, die sich spontan entzünden können.
H314 - Verursacht schwere Verätzungen der Haut und schwere Augenschäden.
Sicherheitshinweise-Hinweise (S-Sätze):
P223 - Keinen Kontakt mit Wasser zulassen.
P231+P232 - Inhalt unter inertem Gas/… handhaben und aufbewahren. Vor Feuchtigkeit schützen.
P280 - Schutzhandschuhe / Schutzkleidung / Augenschutz / Gesichtsschutz tragen.
P305+P351+P338 - Bei Kontakt mit den Augen: Einige Minuten lang behutsam mit Wasser spülen. Eventuell vorhandene Kontaktlinsen nach Möglichkeit entfernen. Weiter spülen.
P370+P378 - Bei Brand: … zum Löschen … verwenden.
Entsorgung von Caesium:
Zur Entsorgung wird dem Metall ein wasserfreier Alkohol wie 2-Pentanol, tert-Butanol oder Octanol zugetropft und die entstandene basische Lösung mit einer Säure neutralisiert.
Externe Informationsangebote
Praktikumsskripten, praktische Anleitungen
Beta-Spektrometrie (BE)
Aufnahme und Diskussion des Gamma-Untergrundes des Zerfalls von 137Cs. Praktikumsskript Physik. TU Dresden - Format: PDF
Isotopengenerator 137Cs/137mBa
Praktikumsskript: Der radiochemische Isotopengenerator 137Cs/137mBa. ETH Zürich - Format: PDF
Gruppenelemente - Informationen
Alkalimetalle
Vorlesungsmaterialien: Chemie der Metalle. Universität Freiburg
Alkalimetalle
Vergleichende Übersicht: chemische und physikalische Eigenschaften. Rutherford Online
Alkalimetalle und Wasserstoff
Kurzbeschreibungen
Chloralkalielektrolyse
Übersicht mit schematischer Darstellung
Chlor-Alkali-Elektrolyse (Amalgamverfahren)
Schematische Darstellung. Universität Bielefeld
Demonstrationen: Alkalimetalle
Versuchsanleitungen zur Chemie der Alkalimetalle. Thomas Seilnacht
Versuche mit Alkalimetallen
Demonstrationsversuche in anorganischer Chemie
Verbindungsklassen
Sauerstoffverbindungen der Alkalimetalle
Oxide, Peroxide, Hyperoxide und Ozonide der Alkalimetalle: Herstellung, Struktur, Bedeutung. Universität Bayreuth
Einzelne Verbindungen
Cäsium und Cäsiumverbindungen
Chemikalien-Datenbank: Übersicht und Eigenschaften einzelner Cäsium-Verbindungen.
Mineralogie
Cäsiumhaltige Minerale
Informationen zum Cäsium und den Cäsiummineralien. Mineralienatlas
Umweltchemie
Belastung von ausgewählten Lebensmitteln mit radioaktiven Stoffen
Caesium-137: arithmetische Jahresmittelwerte in Bq/kg. GBE
Cäsium-Radioaktivität in Pilzen
Ursachen und Bewertung der Cäsium-Belastung 1986 bis 2001. Universität Oldenburg
Radioaktivität im Boden
Cäsium-134 und Cäsium-137. Bericht - Format: PDF
Kategorie: Chemische Elemente
Aktualisiert am 31.01.2020.
Permalink: https://www.internetchemie.info/chemische-elemente/caesium.php
© 1996 - 2026 Internetchemie ChemLin